
【题目】设NA代表阿伏加德罗常数,下列说法正确的是
A. 常温下,5.6g铁与足量的盐酸反应,失去的电子数为0.2NA
B. 标准状况下11.2L二氧化硫中含有的原于数为2NA
C. 标准状况下,22.4L氯气发生反应转移电子数一定为2NA
D. 0.1mol/LCuCl2溶液中Cl-数目是0.2NA
【答案】A
【解析】 A、因为Fe和盐酸反应氧化产物是Fe 2+ ,5.6 g铁失去电子数为0.2 N A,选项A错误;B、B. 标准状况下11.2L二氧化硫中含有的原子数为![]() 3NA=3NA,选项B错误;C、1 mol 氯气参加反应时,氯气可以只做氧化剂,也可以自身氧化还原反应,电子转移数目可以为2NA或NA,选项C错误;D、溶液体积不明确,故溶液中的氯离子的个数无法计算,选项D错误。答案选A。
3NA=3NA,选项B错误;C、1 mol 氯气参加反应时,氯气可以只做氧化剂,也可以自身氧化还原反应,电子转移数目可以为2NA或NA,选项C错误;D、溶液体积不明确,故溶液中的氯离子的个数无法计算,选项D错误。答案选A。
【题型】单选题
【结束】
23
【题目】实验室利用以下反应制取少量氨气:NaNO2+NH4Cl=NaC1+N2↑+2H2O,关于该反应的下列说法正确的是
A. NaNO2发生氧化反应
B. 每生成1molN2转移的电子的物质的量为3mol
C. NH4Cl中的氯元素被还原
D. N2既是氧化剂,又是还原剂
【答案】B
【解析】A、反应NaNO2+NH4C1═NaC1+N2↑+2H2O中,NaNO2中N的化合价从+3价降为0价,NaNO2是氧化剂,发生还原反应,选项A错误;B.反应NaNO2+NH4C1═NaC1+N2↑+2H2O中,化合价升高值=化合价降低值=转移电子数=3,即每生成1molN2时,转移电子的物质的量为3mol,选项B正确; C、NH4C1中的氯元素化合价不变,不被还原;氮元素化合价从-3价升为0价,所以NH4C1中的氮元素被氧化,选项C错误; D.反应NaNO2+NH4C1═NaC1+N2↑+2H2O中,NaNO2中N的化合价从+3价降为0价,NH4C1中的氮元素化合价从-3价升为0价,氮气既是氧化产物又是还原产物,选项D错误。答案选B。


科目:高中化学 来源: 题型:
【题目】某课外小组研究铝土矿中Al2O3的含量。查阅资料得知,铝土矿的主要成分是Al2O3,杂质是Fe2O3、SiO2等。从铝土矿中提取Al2O3的过程如下:
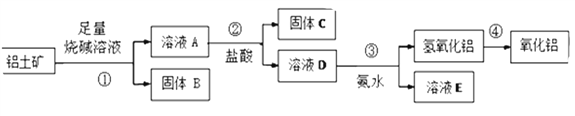
(1)固体B的主要用途有(写出1条即可)__________________________ 。
(2)第①步,向铝土矿中加入足量烧碱溶液后,发生反应的离子方程式是:_____________________________________________________________;___________________________________________________________。
(3)第③步中,生成氢氧化铝的离子方程式是____________________________________________________________。
(4)工业上制取AlCl3用Al2O3与C、Cl2在高温条件下反应,每消耗0.5 mol碳单质,转移1 mol电子,反应的化学方程式是___________________________________________________。
(5)将实验过程中所得固体精确称量。课外小组发现所得氢氧化铝固体的质量与原铝土矿质量相等,则该铝土矿中Al2O3的质量分数是________。(保留一位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有浓度均为0.1molL﹣1的盐酸、硫酸和醋酸三种溶液,试分析:
(1)若溶液的C(H+)分别为a、b、c,则它们的大小关系是(用“>”“<”“=”表示),
(2)分别用三种酸中和等物质的量的氢氧化钠溶液,所需溶液的体积分别是a、b、c,则它们的大小关系是(用“>”“<”“=”表示).
(3)等体积的三种酸分别与足量的锌粒反应,在相同条件下若产生气体的体积分别为a、b、c,则它们的关系是 .
(4)可逆反应2Cl2(g)+2H2O(g)4HCl(g)+O2(g)△H>0,在一定条件下达到平衡后,分别采取下列措施(填“增大”、“减小”或“不变”):
①降低温度,Cl2的转化率;
②保持容器体积不变,加入He,则HCl的物质的量;
③保持容器压强不变,加入He,则O2的体积分数 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】教材中有两个关于混合物分离的实验,请回答下列有关问题
实验一:通过蒸馏的方法除去自来水中含有的氯离子等杂质制取纯净水,如图所示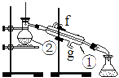
(1)写出下列仪器的名称:①②
(2)若利用以上装置分离酒精和四氯化碳两种溶液的混合物,还缺少的仪器是 , 将仪器补充完整后进行的实验操作的名称是;②的进水口是 (填“f”或“g”)
(3)仪器①中常加入碎瓷片,这样做的目的是
实验二:用CCl4从碘水中萃取I2并分液漏斗分离两种溶液.
其实验操作中有如下两步:①将漏斗上口玻璃塞打开或使塞上的凹槽或小孔准漏斗的小孔.②静置分层后,旋开活塞,用烧杯接收下层液体
(4)这样做的目的是
(5)下层流出的是溶液,上层液体从得到(填“上口”或“下口”)
(6)萃取碘水中的I2单质时要用到萃取剂,下列关于所加萃取剂的说法正确的是
A.不与碘反应
B.碘在其中的溶解度大于在水中的溶解度
C.该萃取剂与水不互溶且密度不同
D.可以选用CCl4 , 酒精灯做萃取剂.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用固态不纯氯化钠(含少量NH4HCO3和Na2SO4杂质)制取纯净氯化钠溶液。下列操作可供选用:
①逐滴加入稀盐酸,调节pH值为5;
②煮沸;
③加蒸馏水溶解;
④加热至不再产生气体为止;
⑤加入稍过量的Na2CO3溶液;
⑥加入稍过量的BaCl2溶液;
⑦过滤。
上述实验操作的正确顺序应是
A.①②⑤⑥⑦③④ B.③④⑥⑤⑦①②
C.④③⑥⑤⑦①② D.④③⑤⑥⑦②①
【答案】C
【解析】
试题分析:NH4HCO3杂质可通过加热除去, Na2SO4杂质可通过BaCl2溶液除去,过量的BaCl2溶液可通过Na2CO3溶液除去,过量的Na2CO3溶液可通过滴加稀盐酸除去,答案选C。
考点:氯化钠的提纯
【题型】单选题
【结束】
22
【题目】设NA代表阿伏加德罗常数,下列说法正确的是
A. 常温下,5.6g铁与足量的盐酸反应,失去的电子数为0.2NA
B. 标准状况下11.2L二氧化硫中含有的原于数为2NA
C. 标准状况下,22.4L氯气发生反应转移电子数一定为2NA
D. 0.1mol/LCuCl2溶液中Cl-数目是0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,可以用铁或铝制的容器贮存浓硫酸,下列叙述中,错误的是
A.浓硫酸具有强还原性
B.贮存浓硫酸的容器要密封,因为浓硫酸容易吸收空气中的水蒸气
C.浓硫酸可以使硫酸铜晶体由蓝色变为白色
D.常温下,浓硫酸可以使铁或铝钝化,生成一层致密的氧化膜,阻止反应继续进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,硝酸只表现氧化性的是( )
A.3FeO+10HNO3═3Fe(NO3)3+NO↑+5H2O
B.C+4HNO3(浓) ![]() CO2↑+4NO2↑+2H2O
CO2↑+4NO2↑+2H2O
C.Al(OH)3+3HNO3═Al(NO3)3+3H2O
D.3Zn+8HNO3═3Zn(NO3)2+2NO↑+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室采用MgCl2、AlCl3混合溶液与过量氨水反应制备MgAl2O4,主要流程如下:
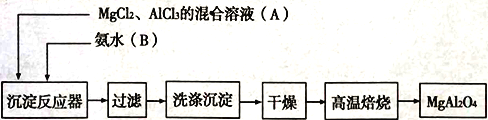
(1)为使Mg2+、Al3+同时生成沉淀,应先向沉淀反应容器中加入________(填“A”、或“B”),再滴加另一反应物。
(2)实验室利用氯化铵和熟石灰反应制取氨气,写出反应的化学方程式________________________。
(3)判断流程中沉淀是否洗净所用的试剂是______________;高温焙烧时,用于盛放固体的仪器名称是__________________。
(4)无水AlCl3(183℃升华)遇潮湿空气即产生大量白雾,实验室可用下列装置制备。

①写出装置A 中发生反应的离子方程式________________________。
②装置B中盛放饱和NaCl溶液,该装置的主要作用是__________;F中试剂的作用是__________;
用一件仪器装填适当试剂后也可起到F和G的作用,所装填的试剂为__________。
③实验步骤:如图连接装置后,先__________(填实验操作),再装药品,然后点燃______(填“ A” 或“C” )处酒精灯,当________(填实验现象)时,再点燃另一处酒精灯。
④写出装置G 中发生反应的离子方程式________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com