
【题目】将浓度为0.1molL﹣1HF溶液加水不断稀释,下列各量始终保持增大的是( )
A.c(H+)
B.Ka(HF)
C.![]()
D.![]()
【答案】D
【解析】解:A、因HF为弱酸,则浓度为0.1molL﹣1HF溶液加水不断稀释,促进电离,平衡正向移动,电离程度增大,n(H+)增大,但c(H+)不断减小,故A错误;
B、因电离平衡常数只与温度有关,则Ka(HF)在稀释过程中不变,故B错误;
C、因稀释时一段时间电离产生等量的H+和F﹣ , 溶液的体积相同,则两种离子的浓度的比值不变,但随着稀释的不断进行,c(H+)不会超过10﹣7molL﹣1 , c(F﹣)不断减小,则比值变小,故C错误;
D、因Ka(HF)= ![]() ,当HF溶液加水不断稀释,促进电离,c(F﹣)不断减小,Ka(HF)不变,则
,当HF溶液加水不断稀释,促进电离,c(F﹣)不断减小,Ka(HF)不变,则 ![]() 增大,故D正确;
增大,故D正确;
故选:D.
根据HF属于弱电解质,则在加水不断稀释时,电离程度增大,电离平衡保持向正反应方向移动,并注意温度不变时,电离平衡常数不变来解答.


 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案科目:高中化学 来源: 题型:
【题目】宋代著名法医学家宋慈 的《洗冤集录》中有﹣银针验毒的记载,“银针验毒”的原理是 4Ag+2H2S+O2═2X+2H2O,下列说法不正确的是( )
A.X的化学式为Ag2S
B.银针验毒时,空气中氧气得到电子
C.反应中Ag和H2S均是还原剂
D.每生成1molX,反应转移2mol e﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外小组研究铝土矿中Al2O3的含量。查阅资料得知,铝土矿的主要成分是Al2O3,杂质是Fe2O3、SiO2等。从铝土矿中提取Al2O3的过程如下:
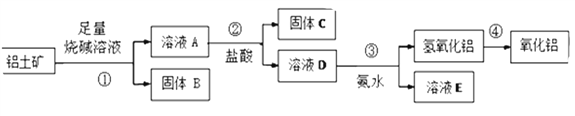
(1)固体B的主要用途有(写出1条即可)__________________________ 。
(2)第①步,向铝土矿中加入足量烧碱溶液后,发生反应的离子方程式是:_____________________________________________________________;___________________________________________________________。
(3)第③步中,生成氢氧化铝的离子方程式是____________________________________________________________。
(4)工业上制取AlCl3用Al2O3与C、Cl2在高温条件下反应,每消耗0.5 mol碳单质,转移1 mol电子,反应的化学方程式是___________________________________________________。
(5)将实验过程中所得固体精确称量。课外小组发现所得氢氧化铝固体的质量与原铝土矿质量相等,则该铝土矿中Al2O3的质量分数是________。(保留一位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,pH均为2的两种一元酸HA和HB各1mL,分别加水稀释,pH随溶液体积的变化曲线如图所示.下列说法正确的是( ) 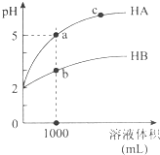
A.HA的酸性比HB的酸性弱
B.a点溶液的导电性比c点溶液的导电性弱
C.若两溶液无限稀释,则它们的c(H+)相等
D.对a、b两点溶液同时升高温度,则 ![]() 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应:M+N﹣→P,如果温度每升高10℃,化学反应速率提高到原来的3倍,在10℃时完成反应的10%需要81min,将温度提高到30℃时,完成反应的10%需要的时间为( )
A.9 min
B.27 min
C.13.5 min
D.3 min
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有浓度均为0.1molL﹣1的盐酸、硫酸和醋酸三种溶液,试分析:
(1)若溶液的C(H+)分别为a、b、c,则它们的大小关系是(用“>”“<”“=”表示),
(2)分别用三种酸中和等物质的量的氢氧化钠溶液,所需溶液的体积分别是a、b、c,则它们的大小关系是(用“>”“<”“=”表示).
(3)等体积的三种酸分别与足量的锌粒反应,在相同条件下若产生气体的体积分别为a、b、c,则它们的关系是 .
(4)可逆反应2Cl2(g)+2H2O(g)4HCl(g)+O2(g)△H>0,在一定条件下达到平衡后,分别采取下列措施(填“增大”、“减小”或“不变”):
①降低温度,Cl2的转化率;
②保持容器体积不变,加入He,则HCl的物质的量;
③保持容器压强不变,加入He,则O2的体积分数 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,可以用铁或铝制的容器贮存浓硫酸,下列叙述中,错误的是
A.浓硫酸具有强还原性
B.贮存浓硫酸的容器要密封,因为浓硫酸容易吸收空气中的水蒸气
C.浓硫酸可以使硫酸铜晶体由蓝色变为白色
D.常温下,浓硫酸可以使铁或铝钝化,生成一层致密的氧化膜,阻止反应继续进行
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com