
【题目】在某学生的化学实验中有如下记录,其中能达到测量要求的是( )
A. 用托盘天平称取35.20 g NaCl B. 用10 mL量筒量取8.5 mL盐酸
C. 用50 mL 烧杯量取15.80 mL溶液 D. 用250 mL 容量瓶量取25 mL溶液
 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:
【题目】景泰蓝是一种传统的手工艺品.下列制作景泰蓝的步骤中,不涉及化学变化的是( )
A | B | C | D |
将铜丝压扁,掰成图案 | 将铅丹、硼酸盐等化合熔制后描绘 | 高温焙烧 | 酸洗去污 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于反应4Al+3TiO2+3C===2Al2O3+3TiC的叙述正确的是:
A. 生成1 mol TiC时转移4 mol电子 B. TiO2是氧化剂,TiC是还原产物
C. 反应中氧化剂与还原剂的物质的量之比是1∶1 D. Al是还原剂,TiC是氧化产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究并回答问题
(1)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验.将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间.
| A | B | C | D | E | F |
4molL﹣1 H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
①请完成此实验设计,其中:V1= , V6= , V9=;
②反应一段时间后,实验A中的金属呈色,实验E中的金属呈色;
③该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高.但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降.请分析氢气生成速率下降的主要原因 .
(2)在100℃和200kPa的条件下,反应aA(g)bB(g)+cC(g)建立平衡后,在不加入任何物质的条件下逐步增大体系的压强(维持温度不变),下表列出的不同压强下反应建立平衡时物质B的浓度.
压强(kPa) | 200 | 500 | 1 000 |
B的浓度(molL﹣1) | 0.04 | 0.1 | 0.27 |
根据表中的数据,回答下列问题:
①压强从200kPa增加到500kPa时,平衡移动(填“正向”“逆向”或“不”),理由是 .
②压强从500kPa增加到1 000kPa时,平衡转移(填“正向”“逆向”或“不”),其原因可能是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】宋代著名法医学家宋慈 的《洗冤集录》中有﹣银针验毒的记载,“银针验毒”的原理是 4Ag+2H2S+O2═2X+2H2O,下列说法不正确的是( )
A.X的化学式为Ag2S
B.银针验毒时,空气中氧气得到电子
C.反应中Ag和H2S均是还原剂
D.每生成1molX,反应转移2mol e﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某无色溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入的NaOH溶液体积的关系如右图所示,由此确定,原溶液中含有的阳离子是:
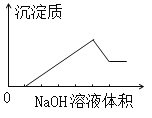
A. Mg2+、Al3+、Fe2+ B. H+、Mg2+、Al3+
C. H+、Ba2+、Al3+ D. 只有Mg2+、Al3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,pH均为2的两种一元酸HA和HB各1mL,分别加水稀释,pH随溶液体积的变化曲线如图所示.下列说法正确的是( ) 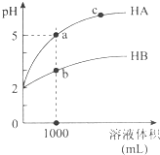
A.HA的酸性比HB的酸性弱
B.a点溶液的导电性比c点溶液的导电性弱
C.若两溶液无限稀释,则它们的c(H+)相等
D.对a、b两点溶液同时升高温度,则 ![]() 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据《本草纲目》有关记载:“水银乃至阴之毒物,因火煅丹砂而出,加以盐、(明)矾而为轻粉(Hg2Cl2),加以硫磺升而为银朱(HgS)”。发生的主要化学反应方程式如下:
①HgS+O2 ===Hg+SO2
② Hg+ NaCl+ KAl(SO4)2+ O2 === Hg2Cl2+ Na2SO4+ Al2O3+ K2SO4
③Hg+S === HgS
请回答下列问题:
(1)在①的方程式中,HgS是做_______
a.氧化剂 b.还原剂 c.既做氧化剂又做还原剂 d.既不做氧化剂又不做还原剂
(2)配平②的化学方程式___________________________________________
(3)实验室制备SO2一般选用浓硫酸与Na2SO3反应。实验室制取SO2并检验其性质的装置与过程如下图:

a. 实验开始前检验气体发生装置气密 性的方法为____________________(说明操作方法、现象和结论)
b. 分析下列装置中的现象分别为
①_________②__________
③_________④__________
c. ⑤的作用为_______________,所涉及的化学反应方程式为:____________________
d. 若在制备SO2时改为用稀盐酸与Na2SO3反应,则可能产生的影响为______________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com