
【题目】根据《本草纲目》有关记载:“水银乃至阴之毒物,因火煅丹砂而出,加以盐、(明)矾而为轻粉(Hg2Cl2),加以硫磺升而为银朱(HgS)”。发生的主要化学反应方程式如下:
①HgS+O2 ===Hg+SO2
② Hg+ NaCl+ KAl(SO4)2+ O2 === Hg2Cl2+ Na2SO4+ Al2O3+ K2SO4
③Hg+S === HgS
请回答下列问题:
(1)在①的方程式中,HgS是做_______
a.氧化剂 b.还原剂 c.既做氧化剂又做还原剂 d.既不做氧化剂又不做还原剂
(2)配平②的化学方程式___________________________________________
(3)实验室制备SO2一般选用浓硫酸与Na2SO3反应。实验室制取SO2并检验其性质的装置与过程如下图:

a. 实验开始前检验气体发生装置气密 性的方法为____________________(说明操作方法、现象和结论)
b. 分析下列装置中的现象分别为
①_________②__________
③_________④__________
c. ⑤的作用为_______________,所涉及的化学反应方程式为:____________________
d. 若在制备SO2时改为用稀盐酸与Na2SO3反应,则可能产生的影响为______________
【答案】 c 12Hg+12NaCl+4KAl(SO4)2+3O2 ===6Hg2Cl2+6Na2SO4+2Al2O3+2K2SO4 连接好发生装置后,关闭分液漏斗活塞,并将导管浸入到水槽中液面下,然后微热试管,待导管中有气泡连续冒出,停止加热,等到冷却后导管内有水柱上升,则证明装置气密性良好 溶液变红 溶液褪色 溶液出现黄色浑浊 溶液褪色 吸收剩余SO2,防止污染空气 2NaOH + SO2 === Na2SO3 + H2O 制取出的SO2会混有HCl杂质
【解析】(1)在①的方程式中Hg元素化合价降低,S元素化合价升高,所以HgS既做氧化剂又做还原剂,答案选c;(2)反应中Hg元素化合价从0价升高到+1价,氧元素化合价从0价降低到-2价,所以根据电子得失守恒与原子守恒可知配平后的方程式为12Hg+12NaCl+4KAl(SO4)2+3O2=6Hg2Cl2+6Na2SO4+2Al2O3+2K2SO4;(3)a.装置中含有分液漏斗,则检验气体发生装置气密性的方法为:连接好发生装置后,关闭分液漏斗活塞,并将导管浸入到水槽中液面下,然后微热试管,待导管中有气泡连续冒出,停止加热,等到冷却后导管内有水柱上升,则证明装置气密性良好;b.①SO2溶于水产生亚硫酸,溶液显酸性,则实验现象是溶液变红;②SO2具有漂白性,则实验现象是溶液褪色;③SO2具有氧化性,能把H2S氧化为单质硫,则实验现象是溶液出现黄色浑浊;④碘水具有氧化性,能氧化SO2,则实验现象是溶液褪色;c.SO2是大气污染物,需要尾气处理,则⑤的作用为吸收剩余SO2,防止污染空气,反应的化学反应方程式为2NaOH+SO2=Na2SO3+H2O;d. 由于盐酸易挥发,则可能产生的影响为制取出的SO2会混有HCl杂质。


科目:高中化学 来源: 题型:
【题目】在某学生的化学实验中有如下记录,其中能达到测量要求的是( )
A. 用托盘天平称取35.20 g NaCl B. 用10 mL量筒量取8.5 mL盐酸
C. 用50 mL 烧杯量取15.80 mL溶液 D. 用250 mL 容量瓶量取25 mL溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A+B→C分两步进行:①A+B→X,②X→C,反应过程中能量变化如图所示,E4表示反应A+B→X的活化能,下列有关叙述正确的是( ) 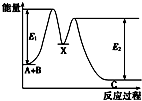
A.Ee表示反应X→C的活化能
B.X是反应A+B→C的催化剂
C.反应A+B→C的△H<0
D.加入催化剂可改变反应A+B→C的焓变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列检验铵盐的方法中,正确的是
A.加入氢氧化钠溶液,加热试管,再滴入酚酞试液
B.加入氢氧化钠溶液,加热试管,并用湿润的红色石蕊试纸接近试管口上方
C.加热试管,并用湿润的红色石蕊试纸接近试管口上方
D.加水溶解,再用红色石蕊试纸检验其溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由硫铁矿烧渣(主要成分:Fe3O4、Fe2O3和FeO)得到绿矾(主FeSO47H2O),再通过绿矾制备铁黄[FeO(OH)]的流程如下:烧渣 ![]() 溶液
溶液 ![]() 绿矾
绿矾 ![]() 铁黄 已知:FeS2和铁黄均难溶于水下列说法不正确的是( )
铁黄 已知:FeS2和铁黄均难溶于水下列说法不正确的是( )
A.步骤①,最好用硫酸来溶解烧渣
B.步骤②,涉及的离子反应为FeS2+14Fe3++8H2O═15Fe2++2SO42﹣+16H+
C.步骤③,将溶液加热到有较多固体析出,再用余热将液体蒸干,可得纯净绿矾
D.步骤④,反应条件控制不当会使铁黄中混有Fe(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(12分)铝是应用广泛的金属.以铝土矿(主要成分为Al2O3 , 含SiO2和Fe2O3等杂质)为原料制备铝的一种工艺流程如下: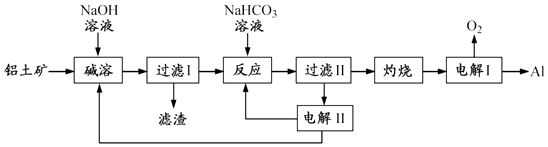
注:SiO2在“碱溶”时转化为铝硅酸钠沉淀.
(1)“碱溶”时生成偏铝酸钠的离子方程式为 .
(2)向“过滤Ⅰ”所得滤液中加入NaHCO3溶液,溶液的pH (填“增大”、“不变”或“减小”).
(3)“电解Ⅰ”是电解熔融 Al2O3 , 电解过程中作阳极的石墨易消耗,原因是 .
(4)“电解Ⅱ”是电解Na2CO3溶液,原理如图所示.
阳极的电极反应式为 , 阴极产生的物质A的化学式为 .
(5)铝粉在1000℃时可与N2反应制备AlN.在铝粉中添加少量NH4Cl固体并充分混合,有利于AlN的制备,其主要原因是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】兰州地区进入秋冬季节后,经常早晨有雾。从物质的分类来看雾属于胶体,他区别于溶液等其他分散系的本质特征是
A. 胶体有丁达尔效应 B. 胶体是混合物
C. 胶体的粒子直径在1—100nm之间 D. 胶体的分散剂为气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下图所示物质相互转化关系,其中A 为单质,试回答:
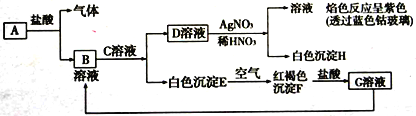
(1)写出下列物质的化学式:C____________;H_________________。
(2)写出A与水蒸气反应的化学方程式___________________________________。
(3)实验室保存B溶液时常加入少量固体A,其原因是___________________________________。
(4)写出E转变成F的化学方程式___________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com