
【题目】一氧化碳是一种重要的化工原料。结合所学知识回答下列问题:
(1)工业上可通过CO和H2化合制取CH3OH:
CO(g)+2H2(g)![]() CH3OH(g) △H1
CH3OH(g) △H1
已知:①CO(g)+H2O(g)=CO2(g)+H2(g) △H2=-41.1kJ·mol-1
②CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H3=-49.0kJ·mol-1
则△H1=___。
(2)二氧化碳的回收利用是环保领域研究的热点课题。
在太阳能的作用下,以CO2为原料制取炭黑的流程如图所示。其总反应的化学方程式为___。
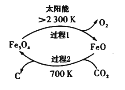
(3)工业上还可通过CO和Cl2化合制取光气(COCl2):Cl2(g) +CO(g)=COCl2(g) △H。向密闭容器中充入1molCl2(g)和1molCO(g),反应速率随温度的变化如图所示。
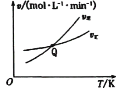
①图中Q点的含义是___,△H___0(填“>”或“<”)。
②某温度下,该反应达到平衡时c(COCl2)=0.80molL-1,c(Cl2)=0.20molL-1,则平衡体系中CO的体积分数为___(保留2位小数)。在该温度下,反应的平衡常数K=___。
(4)以稀硫酸为电解质溶液,利用太阳能将CO2转化为低碳烯烃,工作原理如图:
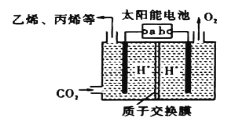
①b电极的名称是___。
②生成丙烯(C3H6)的电极反应式为___。
【答案】-90.1kJ·mol-1 CO2![]() C+O2 化学平衡状态 < 16.67% 20 正极 3CO2+18H++18e-→CH3CH=CH2+6H2O
C+O2 化学平衡状态 < 16.67% 20 正极 3CO2+18H++18e-→CH3CH=CH2+6H2O
【解析】
(1)根据盖斯定律计算;
(2)根据图像可知,反应物为二氧化碳,生成物为炭黑和氧气;
(3)根据图像可知,升高温度,正逆反应速率均增大,且逆反应速率增大的程度大于正反应速率,则升高温度,平衡逆向移动,逆向反应为吸热,则正反应为放热反应。
(4)①根据图知,氧的化合价由-2变为0价,失电子,则生成氧气的电极是阳极,则连接阳极的电源电极为正极;
②阴极上二氧化碳得电子和氢离子反应生成丙烯和水。
(1)根据盖斯定律可知,①+②可得CO(g)+2H2(g)![]() CH3OH(g),则△H1=△H2+△H3=-90.1kJ·mol-1;
CH3OH(g),则△H1=△H2+△H3=-90.1kJ·mol-1;
(2)根据图像可知,反应物为二氧化碳,生成物为炭黑和氧气,则方程式为CO2![]() C+O2;
C+O2;
(3)根据图像可知,升高温度,正逆反应速率均增大,且逆反应速率增大的程度大于正反应速率,则升高温度,平衡逆向移动,逆向反应为吸热,则正反应为放热反应。
①根据图像可知在Q点之前为建立平衡的过程,而Q点之后为平衡移动的过程,且随着温度的升高平衡逆向移动,Q点为化学平衡状态;正反应为放热反应,则△H<0;
②初始时,充入等物质的量的Cl2、CO,根据Cl2(g)+CO(g)=COCl2(g),平衡时,c(Cl2)=c(CO)=0.20molL-1,平衡体系中CO的体积分数=![]() ×100%=16.67%;K=
×100%=16.67%;K=![]() =20;
=20;
(4)①根据图知,氧的化合价由-2变为0价,失电子,则生成氧气的电极是阳极,则连接阳极的电源电极为正极,所以b为正极;
②阴极上二氧化碳得电子和氢离子反应生成丙烯和水,电极反应式为3CO2+18H++18e-→CH3CH=CH2+6H2O。


科目:高中化学 来源: 题型:
【题目】现有室温下四种溶液,有关叙述不正确的是
编号 | ① | ② | ③ | ④ |
pH | 10 | 10 | 4 | 4 |
溶液 | 氨水 | 氢氧化钠溶液 | 醋酸溶液 | 盐酸 |
A. 相同体积③、④溶液分别与NaOH完全反应,消耗NaOH物质的量:③>④
B. 分别加水稀释10倍,四种溶液的pH:①>②>④>③
C. ①、④两溶液等体积混合,所得溶液中c(NH4+)>c(Cl-)>c(OH-)>c(H+)
D. VaL④溶液与VbL②溶液混合(近似认为混合溶液体积=Va+Vb),若混合后溶液pH=5,则Va︰Vb=9︰11
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列各实验装置进行相应的实验,能达到实验目的的是
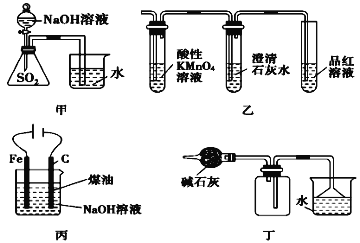
A. 用图甲装置证明SO2与NaOH溶液发生了反应
B. 用图乙装置检验某混合气体是否由SO2和CO2混合而成
C. 用图丙装置制备Fe(OH)2并能较长时间观察其颜色
D. 用图丁装置干燥、收集氯化氢,并吸收多余的氯化氢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有四种不同堆积方式的金属晶体的晶胞如图所示,有关说法正确的是( )
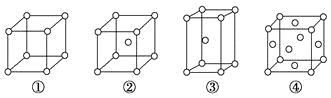
A. ①为简单立方堆积 ②为六方最密堆积 ③为体心立方堆积 ④为面心立方最密堆积
B. 每个晶胞含有的原子数分别为:①1个,②2个,③2个,④4个
C. 晶胞中原子的配位数分别为:①6,②8,③8,④12
D. 空间利用率的大小关系为:①<②<③<④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醛(![]() )在Ni催化作用下加氢可得甲醇(CH3OH),以下说法中正确的是
)在Ni催化作用下加氢可得甲醇(CH3OH),以下说法中正确的是
A. 甲醛分子间可以形成氢键B. 甲醛分子和甲醇分子内C原子均采取sp2杂化。
C. 甲醛为极性分子D. 甲醇的沸点远低于甲醛的沸点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁—次氯酸盐燃料电池的工作原理如右图所示,该电池反应为:
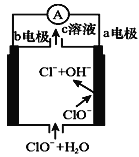
Mg+ClO-+H2O=Mg(OH)2+Cl-
下列有关说法正确的是( )
A.电池工作时,c溶液中的溶质是MgCl2
B.负极反应式:ClO--2e-+H2O=Cl-+2OH-
C.电池工作时,OH-向b电极移动
D.b电极发生还原反应,每转移0.1 mol电子,理论上生成0.1 mol Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒容密闭容器中进行的可逆反应2NO2![]() 2NO +O2,可作为达到平衡状态的标志是( )
2NO +O2,可作为达到平衡状态的标志是( )
①单位时间内生成amo1O2的同时生成2amolNO2 ;
②单位时间内生成amolO2的同时生成2amolNO;
③混合气体的颜色不再改变;
④混合气体的密度不再改变的状态;
⑤混合气体的平均相对分子质量不再改变的状态;
⑥容器内的压强不再改变。
A.①②③④⑤B.②④⑤⑥C.①③④⑥D.①③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若用AG表示溶液的酸度,AG的定义为AG=lg![]() 。室温下实验室中用0.01 mol·L-1的氢氧化钠溶液滴定20.00 mL 0.01 mol·L-1醋酸,滴定过程如图所示,下列叙述正确的是
。室温下实验室中用0.01 mol·L-1的氢氧化钠溶液滴定20.00 mL 0.01 mol·L-1醋酸,滴定过程如图所示,下列叙述正确的是
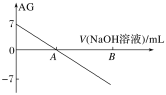
A.室温下,醋酸的电离常数约为10-5
B.A点时加入氢氧化钠溶液的体积为20.00 mL
C.若B点为40 mL,所得溶液中:c(Na+)=c(CH3COO-)+c(CH3COOH)
D.从A到B,水的电离程度逐渐变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜板上铁铆钉长期暴露在潮湿的空气中,形成一层酸性水膜后铁铆钉会被腐蚀,示意图如图所示。下列说法不正确的是
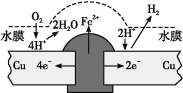
A.因铁的金属性比铜强,所以铁铆钉被氧化而腐蚀
B.若水膜中溶解了SO2,则铁铆钉腐蚀的速率变小
C.铜极上的反应是2H++2e =H2↑、O2+4e+4H+=2H2O
D.在金属表面涂一层油脂,能防止铁铆钉被腐蚀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com