
短周期元素A、B、C、D位于同周期且原子序数依次增大。已知A、C、D三种元素原子的最外层共有10个电子,且这三种元素的最高价氧化物所对应的水化物之间两两皆能反应,均生成盐和水。请完成下列各小题:
(1)A、B、C三种阳离子的半径由大到小的顺序是:____>_____>____(填写离子符号)。
(2)指出元素D在元素周期表中的位置:第________周期第________族。
(3)元素B的氧化物属于________化合物(填“离子”或“共价”),其电子式为________________。
(4)A、C元素的最高价氧化物所对应的水化物之间反应的离子方程式为________________。
(5)含有C阳离子的盐常用来净化水,其原因为______________(用离子方程式表示和适当的文字说明)。
科目:高中化学 来源: 题型:填空题
X、Y、Z、W四种化合物均由短周期元素组成。其中X含有四种元素,X、Y、Z的焰色反应均为黄色,W为无色无味气体。这四种化合物具有下列转化关系(部分反应物、产物及反应条件已略去)。
请回答:
(1)W的电子式是 。
(2)X与Y在溶液中反应的离子方程式是 。
(3)X含有的四种元素之间(二种、三种或四种)可组成多种化合物,选用其中某些化合物,利用下图装置(夹持固定装置已略去)进行实验,装置Ⅲ中产生白色沉淀,装置Ⅴ中可收集到一种无色气体。
①装置Ⅰ中反应的化学方程式是 ,
装置Ⅱ中物质的化学式是 。
②用X含有的四种元素中的两种组成的某化合物,在催化剂存在下制备并收集纯净干燥的装置Ⅴ中气体,该化合物的化学式是 ,所需仪器装置是 。
(从上图选择必要装置,填写编号)
(4)向Z溶液中通入氯气,可制得某种生产和生活中常用的漂白、消毒的物质,同时有X生成,该反应的化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
铁在冷的浓硫酸中能发生钝化。某兴趣小组的同学发现将一定量的铁与浓硫酸加热时,观察到铁完全溶解,并产生大量气体。实验室现有下列试剂:0.01 mol/L酸性KMnO4溶液、0.1 mol/L KI溶液、3%H2O2溶液、淀粉溶液、蒸馏水。请你协助他们探究所得溶液和气体的成分。
【提出猜想】
Ⅰ.所得溶液中的金属离子可能含有Fe2+和Fe3+中的一种或两种;
Ⅱ.所得气体中可能含有________中的一种或两种。
| | 实验操作 | 预期现象 | 结论 |
| 验证猜想Ⅰ | 步骤①:取少量0.01 mol/L酸性KMnO4溶液,滴入所得溶液 | | |
| 步骤②:________ | | 含有Fe3 | |
| 验证猜想Ⅱ | 将所得气体通入如下装置 | | 含有两种气体 |
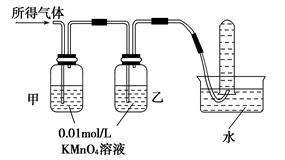
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
纯碱是一种重要的化工原料。目前制碱工业主要有“氨碱法”和“联合制碱法”两种工艺。请按要求回答问题:
(1)“氨碱法”产生大量CaCl2废弃物,请写出该工艺中产生CaCl2的化学方程式:___________________________。
(2)写出“联合制碱法”有关反应的化学方程式:_______________________
(3)CO2是制碱工业的重要原料,“联合制碱法”与“氨碱法”中CO2的来源有何不同?_______________________。
(4)绿色化学的重要原则之一是提高反应的原子利用率。根据“联合制碱法”总反应列出计算原子利用率的表达式:原子利用率(%)=_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
取A、B两份物质的量浓度相等的NaOH溶液,体积均为50 mL,分别向其中通入一定量的CO2后,再分别稀释为100 mL。
(1)在NaOH溶液中通入一定量的CO2后,溶液中的溶质的组成可能是:
① ;② ;③ ;④ 。
(2)在稀释后的溶液中分别逐滴加入0.1 mol·L-1的盐酸,产生的CO2的体积(标准状况)与所加盐酸的体积关系如图所示。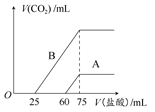
①分别加入足量的盐酸后,溶液中的溶质是 ,原NaOH溶液的物质的量浓度是 。
②A曲线表明,通入CO2后,溶液中的溶质是 ,与盐酸反应产生CO2的最大体积是 mL(标准状况)。
③B曲线表明,原NaOH溶液通入CO2后,所得溶质的化学式为 ,其物质的量之比为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
实验室制备甲酸铜晶体[Cu(HCOO)2·4H2O]的流程如下: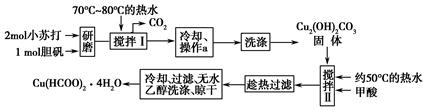
回答下列问题:
(1)小苏打水溶液显________性(填“酸”、“碱”或“中”)可治疗胃酸(0.2%~0.4%的盐酸)过多,反应的离子方程式为________________________。
(2)生成碱式碳酸铜[Cu2(OH)2CO3]的离子方程式为________________________。
(3)操作a的名称是________,该操作使用的玻璃仪器有________。
(4)证明碱式碳酸铜已经洗涤充分的实验操作是________________________________。
(5)用无水乙醇洗涤晶体的目的是___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
部分铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式:
________________________________________________________________。
(2)若将(1)中的反应设计成原电池,请画出原电池的装置图,标出正、负极,并写出电极反应式。
正极反应: _________________________________________;
负极反应:__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
为了降低电子垃圾对环境构成的影响,将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线: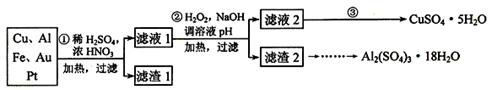
(1)第①步Cu与混酸反应的离子方程式为______________________________。得到滤渣1的主要成分为_________________。
(2)第②步中加入H2O2的作用是__________________,使用H2O2的优点是_________;调溶液pH的目的是____________________________________。
(3)简述第③步由滤液2得到CuSO4·5H2O的方法是_________________________
____________________________________________________________ 。
(4)由滤渣2制取Al2(SO4)3·18H2O ,设计了以下三种方案: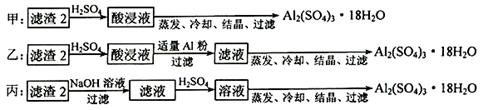
上述三种方案中,_______方案不可行,原因是_______________________________;
从原子利用率角度考虑,_______方案更合理。
(5)用滴定法测定CuSO4·5H2O含量。取a g试样配成100 mL溶液,每次取20.00 mL,消除干扰离子后,用c mol·L-1 EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液b mL。滴定反应如下:Cu2+ + H2Y2-→ CuY2- + 2H+。写出计算CuSO4·5H2O质量分数的表达式ω= __________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下列转化关系中,X、Y是生活中用途广泛的两种金属单质,A、B是氧化物,A呈红棕色,C、D、E是中学常见的三种化合物。分析转化关系回答问题: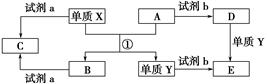
(1)请写出反应①的化学方程式___________________________________________。
(2)检验D溶液中Y离子的方法是_____________________________________。
(3)若试剂a是NaOH溶液,写出单质X与NaOH溶液反应的离子方程式______________________________。
(4)若试剂b是H2SO4,工业上用E、H2SO4和NaNO2为原料制取高效净水剂Y(OH)SO4,已知还原产物为NO,则该反应的化学方程式是_____________________________________________________________________。
(5)工业上电解熔融的B制取X时,若阳极产生的气体在标准状况下的体积为33.6 m3,则阴极产物的质量为________kg。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com