
【题目】MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,发生氧化反应的物质是_______,氧化剂是_____________,还原剂是_____________,氧化产物是_____________,还原产物是_____________。
MnCl2+Cl2↑+2H2O,发生氧化反应的物质是_______,氧化剂是_____________,还原剂是_____________,氧化产物是_____________,还原产物是_____________。
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】25℃时,将浓度均为0.1mol/L、体积分别为Va和Vb的HA溶液与BOH溶液按不同体积比混合,保持Va+Vb=100nL,Va、Vb与混合液的p的关系如图所示。下列说法正确的是

A. Ka(HA)=Kb(BOH)=1×10-6B. b点时,c(A-)=c(B+)=c(H+)=c(OH-)
C. c点时,c(A-)>c(B+)D. a→c过程中![]() 不变
不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 甲醇燃料电池工作时,甲醇得到电子,发生还原反应
B. 室温下,稀释0.1 mol·L-1氨水,c(H+)·c(NH3·H2O)的值减小
C. 将1 mol Cl2通入水中,HClO、Cl-、ClO-粒子数之和为2×6.02×1023
D. SiO2(s)+2C(s)===Si(s)+2CO(g)在常温下不能自发进行,则该反应的ΔH<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[实验化学]
8羟基喹啉(![]() )是白色或淡黄色粉末,可通过如下实验步骤制得:
)是白色或淡黄色粉末,可通过如下实验步骤制得:
①如图所示,在三颈烧瓶中加入适量甘油、邻硝基苯酚、邻氨基苯酚和浓硫酸。

②加热至反应自动激烈进行。
③改为水蒸气蒸馏装置进行水蒸气蒸馏,直至馏出液中不再有油珠为止。
④向三颈烧瓶中加入一定量NaOH溶液后,再滴加饱和Na2CO3溶液将pH调至7~8。
⑤重新进行水蒸气蒸馏,至馏出液中不再有晶体析出。
⑥将馏出液充分冷却后抽滤,进一步精制得产品。
(1)上图中冷却水应从________(填“A”或“B”)口进。

(2)上图是水蒸气发生装置。第一次水蒸气蒸馏的目的是___________________________________;当冷凝管出现堵塞时,图中可观察到的现象是_________________________________________。
(3)抽滤装置中,布氏漏斗进入抽滤瓶的部分不宜过长,其原因是________________________________。
(4)步骤②中移开火源,反应仍自动激烈进行的原因是__________________________________。
(5)步骤④中加入的饱和Na2CO3溶液不能过量的原因是__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,取pH=2的两种二元酸H2A与H2B各1 mL,分别加水稀释,测得pH变化与加水稀释倍数有如图所示关系,则下列有关叙述正确的是( )

A. H2A的电离方程式为H2A ![]() H++HA-,HA-
H++HA-,HA- ![]() H++A2
H++A2
B. pH=4的H2A水溶液中c(OH-)=10-12 mol·L-1
C. NaHA、NaHB的混合溶液中,阴离子有A2-、HA-、HB-、B2-、OH-
D. Na2B的水溶液能与H2A溶液发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组的同学查阅相关资料知,氧化性:Cr2O72->Fe3+,设计了如图所示的盐桥原电池。盐桥中装有琼脂与饱和K2SO4溶液。下列叙述中正确的是

A. 甲烧杯的溶液中发生还原反应
B. 外电路的电流方向是从b到a
C. 电池工作时,盐桥中的SO42-移向乙烧杯
D. 乙烧杯中发生的电极反应为:2Cr3++7H2O-6e-===Cr2O72-+14H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合硫酸铁(简称PFS或聚铁)是水处理中重要的絮凝剂。以黄铁矿的烧渣(主要成分为Fe2O3、FeO、SiO2等)为原料制取聚合硫酸铁(![]() )的工艺流程如下:
)的工艺流程如下:
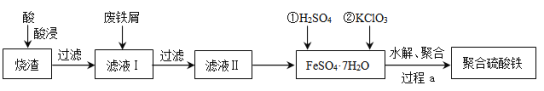
(1)酸浸时最合适的酸是_____(写化学式)。
(2)酸浸后溶液中主要的阳离子有_____。
(3)加入KClO3的目的是_____________________________(结合离子方程式说明)。
(4)过程a中生成聚合硫酸铁的过程是先水解再聚合。将下列水解反应原理的化学方程式补充完整。
_____Fe2(SO4)3+_____H2O![]() ______Fe2(OH)x(SO4)3-
______Fe2(OH)x(SO4)3-![]() + _____ ______
+ _____ ______
(5)过程a中水解要严控pH的范围。pH偏小或偏大聚合硫酸铁的产率都会降低,请解释原因__________。
(6)盐基度B是衡量絮凝剂絮凝效果的重要指标,通常盐基度越高,絮凝效果越好。盐基度B的表达式:![]() (n为物质的量)。为测量聚合硫酸铁的盐基度,进行如下实验操作:
(n为物质的量)。为测量聚合硫酸铁的盐基度,进行如下实验操作:
ⅰ.取聚合硫酸铁样品m g,加入过量盐酸,充分反应,再加入煮沸后冷却的蒸馏水,再加入KF溶液屏蔽Fe3+,使Fe3+不与OH-反应。然后以酚酞为指示剂,用c mol/L的标准NaOH溶液进行中和滴定,到终点时消耗NaOH溶液V mL。
ⅱ.做空白对照实验,取与步骤ⅰ等体积等浓度的盐酸,以酚酞为指示剂,用c mol/L的标准NaOH溶液进行中和滴定,到终点时消耗NaOH溶液V0 mL。
①该聚合硫酸铁样品中n(OH-) =_________mol。
②已知该样品中Fe的质量分数w,则盐基度B=_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某密闭容器中发生如下反应:X(g)+3Y(g)![]() 2Z(g);ΔH<0。下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是
2Z(g);ΔH<0。下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是

A. t2时加入了催化剂 B. t3时降低了温度
C. t5时增大了压强 D. t4~t5时间内转化率一定最低
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com