
【题目】全钒液流电池是一种新型的绿色环保储能电池,工作原理如图所示,a、b均为惰性电极,放电时左槽溶液颜色由黄色变为蓝色。下列叙述正确的是
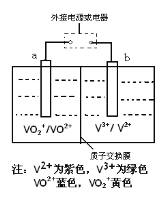
A.充电时右槽溶液颜色由紫色变为绿色
B.放电时,b极发生还原反应
C.充电过程中,a极的反应式为:VO2++2H++e—= VO2+ +H2O
D.电池的总反应可表示为:VO2++V2++2H+ ![]() VO2++V3++H2O
VO2++V3++H2O
科目:高中化学 来源: 题型:
【题目】已知Fe3O4是一种复杂的化合物,其化学式可改写为FeO·Fe2O3。对于A中生成的黑色物质,有三个学习小组提出了三种不同的猜想,以下是小组同学进行的实验猜想与探究,请你根据小组的思路与提示完成相关空白。
(猜想)甲组:黑色物质是FeO
乙组:黑色物质是Fe3O4
丙组:_____________;
(实验探究)
(1)丙组认为一种简单定性的方法即可判断甲组的正误:取A中生成的黑色物质少许于烧杯,加稀盐酸使其完全溶解,再加______溶液以检验Fe3+,观察到溶液有无出现_________现象即可判断。
(2)乙组认为可通过定量测定来确定A中生成的黑色物质的组成,以验证该组猜想正确。取A中生成的黑色物质2.32g溶解于适量稀盐酸后,加入新制氯水,加入氯水后反应的离子方程式为:_____________,再加入足量NaOH溶液后,过滤洗涤烘干灼烧称量,若称得固体质量为________,即可判断乙组同学猜想正确。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ·mol-1、-283.0kJ·mol-1和-726.5kJ·mol-1。那么用太阳能分解10mol水消耗的能量是____________kJ;
(2)由合成气(组成为H2、CO和少量的CO2)直接制备二甲醚,其中的主要过程包括以下四个反应:
甲醇合成反应:
(i)CO(g) + 2H2(g) = CH3OH(g) △H1 = -90.1kJmol-1
(ii)CO2(g) + 3H2(g) = CH3OH(g) + H2O(g) △H2 = -49.0kJmol-1
水煤气变换反应:
(iii)CO(g) + H2O(g) = CO2(g) + H2 (g) △H3 = -41.1kJmol-1
二甲醚合成反应:
(iV)2 CH3OH(g) = CH3OCH3(g) + H2O(g) △H4 = -24.5kJmol-1
则由H2和CO直接制备二甲醚(另一产物为水蒸气)的热化学方程式为____________。
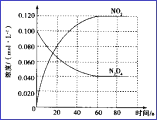
(3)在容积为1.00L的容器中,通入一定量N2O4,发生N2O4(g) ![]() 2NO2(g), 100℃时,体系中各物质浓度随时间变化如图所示。在0~60s时段,v(N2O4)=_______________________,
2NO2(g), 100℃时,体系中各物质浓度随时间变化如图所示。在0~60s时段,v(N2O4)=_______________________,
(4)已知反应2HI(g)=H2(g) + I2(g)的ΔH= +11kJ·mol-1,1molH2(g)、1mol I2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1molHI(g)分子中化学键断裂时需吸收的能量为___________kJ。在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表
t/min | 0 | 20 | 40 | 60 | 80 | 120 |
x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
上述反应中,正反应速率为v正= k正·x2(HI),逆反应速率为v逆=k逆·x(H2)·x(I2),其中k正、k逆为速率常数, 若k正 = 0.0027min-1,在t=40min时,v正=_______min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常利用以下反应制取少量氮气:NaNO2+NH4Cl![]() NaCl+N2↑+2H2O;关于该反应的下列说法不正确的是( )
NaCl+N2↑+2H2O;关于该反应的下列说法不正确的是( )
A. Na2NO2是氧化剂,NH4Cl是原剂
B. N2既是氧化产物,又是还原产物
C. NH4Cl中氮元素被还原
D. 每生成1molN2转移电子的物质的量为3mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知室温时,0.1mo1/L某一元酸HA在水中有0.1%发生电离,下列叙述错误的是
A. 该溶液的pH=4
B. 升高温度,溶液的pH增大
C. 此酸的电离平衡常数约为1×10-7
D. 由HA电离出的c(H+)约为水电离出的c(H+)的106倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法中正确的是( )
A. 已知25 ℃时NH4CN溶液显碱性,则25 ℃时的电离常数K(NH3·H2O)>K(HCN)
B. 室温时, 相同体积、相同pH的盐酸和醋酸溶液中由水电离出的c(H+):盐酸小于醋酸溶液
C. 已知Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=9.0×10-12,向含有Cl-、CrO42-且浓度均为0.010 mol·L-1溶液中逐滴加入0.010 mol·L-1的AgNO3溶液时, CrO42-先产生沉淀
D. 常温下pH=7的CH3COOH和NaOH混合溶液中,c(Na+)>c(CH3COO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某有机物A:
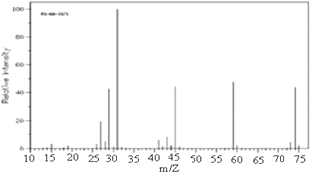
①由C、H、O三种元素组成,经燃烧分析实验测定其碳的质量分数是64.86%,氢的质量分数是13.51%;
②如图是该有机物的质谱图
③A的红外光谱图上有C-H键、O-H键、C-O键的振动吸收峰.
④A的核磁共振氢谱有两个峰.请回答:
(1)A的实验式(最简式)为_____________,分子式为_____________;
(2)已知A的最简式能否确定A的分子式(填“能”或“不能”)_______,为什么?________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】德国重离子研究中心2010年2月19日宣布,由该中心人工合成的第ll2号化学元素从即日起获正式名称“Copemicium”,相应的元素符号为“Cn”。该元素的名称是为了纪念著名天文学家哥白尼而得名。该中心人工合成Cn的过程可表示为:7030Zn+20882Pb→277112Cn+10n。下列叙述中正确的是 ( )
A. 上述合成过程属于化学变化
B. Cn元素位于元素周期表的第七周期,是副族元素
C. Cn元素的相对原子质量为277
D. 277112Cn的原子核内质子数比中子数多53
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计了一个甲醇(CH3OH)燃料电池,并用该电池电解200mL一定浓度NaCl与CuSO4混合溶液,其装置如图1:
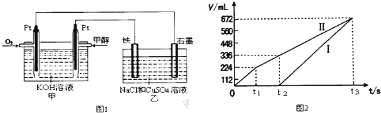
(1)25℃,1.01×105Pa时16g液态甲醇完全燃烧,当恢复至原状态时,放出362.9kJ热量,此反应的热化学方程式为 。
(2)写出甲中通入甲醇这一极的电极反应式 。
(3)铁电极上反应的现象为:先有红色的物质析出,后 。
石墨电极上产生的气体是 。
(4)理论上乙中两极所得气体的体积随时间变化的关系如图2所示(气体体积已换算成标准状况下的体积)原混合溶液中CuSO4的物质的量浓度 mol·L-1。(假设溶液体积不变)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com