
【题目】(1)已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ·mol-1、-283.0kJ·mol-1和-726.5kJ·mol-1。那么用太阳能分解10mol水消耗的能量是____________kJ;
(2)由合成气(组成为H2、CO和少量的CO2)直接制备二甲醚,其中的主要过程包括以下四个反应:
甲醇合成反应:
(i)CO(g) + 2H2(g) = CH3OH(g) △H1 = -90.1kJmol-1
(ii)CO2(g) + 3H2(g) = CH3OH(g) + H2O(g) △H2 = -49.0kJmol-1
水煤气变换反应:
(iii)CO(g) + H2O(g) = CO2(g) + H2 (g) △H3 = -41.1kJmol-1
二甲醚合成反应:
(iV)2 CH3OH(g) = CH3OCH3(g) + H2O(g) △H4 = -24.5kJmol-1
则由H2和CO直接制备二甲醚(另一产物为水蒸气)的热化学方程式为____________。
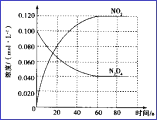
(3)在容积为1.00L的容器中,通入一定量N2O4,发生N2O4(g) ![]() 2NO2(g), 100℃时,体系中各物质浓度随时间变化如图所示。在0~60s时段,v(N2O4)=_______________________,
2NO2(g), 100℃时,体系中各物质浓度随时间变化如图所示。在0~60s时段,v(N2O4)=_______________________,
(4)已知反应2HI(g)=H2(g) + I2(g)的ΔH= +11kJ·mol-1,1molH2(g)、1mol I2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1molHI(g)分子中化学键断裂时需吸收的能量为___________kJ。在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表
t/min | 0 | 20 | 40 | 60 | 80 | 120 |
x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
上述反应中,正反应速率为v正= k正·x2(HI),逆反应速率为v逆=k逆·x(H2)·x(I2),其中k正、k逆为速率常数, 若k正 = 0.0027min-1,在t=40min时,v正=_______min-1
【答案】 2858 2CO(g)+4H2(g)=CH3OCH3(g) +H2O(g) △=-204.7 kJmol-1 0.0010mol/(L·s) 299 1.95×10-3
【解析】(1)由H2(g)的燃烧热△H为﹣285.8kJmol﹣1知,1molH2(g)完全燃烧生成1molH2O(l)放出热量285.8kJ,即分解1mol H2O(l)为1mol H2(g)消耗的能量为285.8kJ,则分解10mol H2O(l)消耗的能量为285.8kJ×10=2858kJ。
(2)(i)CO(g)+2H2(g)═CH3OH(g)△H1=﹣90.1kJmol﹣1;(iV)2CH3OH(g)═CH3OCH3(g)+H2O(g)△H4=﹣24.5kJmol﹣1;依据盖斯定律,由(i)×2+(iV)可以得到由H2和CO直接制备二甲醚的热化学方程式:2CO(g)+4H2(g)=CH3OCH3+H2O(g) △H=﹣204.7kJmol﹣1。
(3)由图可知,在0~60s时段,的浓度由0.100 mol/L减小到0.040 mol/L,减小了0.060 mol/L,所以v(N2O4)= ![]() =0.0010mol/(L·s)。
=0.0010mol/(L·s)。
(4)已知反应2HI(g)=H2(g) + I2(g)的ΔH= +11kJ·mol-1,1molH2(g)、1mol I2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,ΔH=反应物的键能总和-生成物的键能总和,则1molHI(g)分子中化学键断裂时需吸收的能量为(+11kJ+436kJ +151kJ)![]() +299kJ。由表中数据可知,在t=40min时,x(HI)= 0.85 ,若k正 = 0.0027min-1,v正= k正·x2(HI)=0.0027min-1
+299kJ。由表中数据可知,在t=40min时,x(HI)= 0.85 ,若k正 = 0.0027min-1,v正= k正·x2(HI)=0.0027min-1![]() 1.95×10-3min-1。
1.95×10-3min-1。


科目:高中化学 来源: 题型:
【题目】(1)官能团与有机物的性质密切相关。
①下列物质易溶于水的是_____________________(填字母)。
a.异丁烷 b.乙醇 c.氯乙烯
②下列物质不能发生水解反应的是_____________________(填字母)。
a.葡萄糖 b.溴乙烷 c.乙酸乙酯
③可用酸性KMnO4溶液鉴别的一组物质是_____________________(填字母)。
a.甲烷与乙烷 b.乙烯与乙炔 c.苯和甲苯
(2)对香豆酸的结构简式如右图所示。
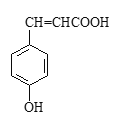
①对香豆酸分子中位于同一平面的碳原子最多有_____________________个。
②1mol对香豆酸最多可与____________________ molH2发生加成反应。
③聚对香豆酸的结构简式为____________________。
(3)D(胡椒醛)是一种食品香料,以A为原料制备D的一种合成路线如下:
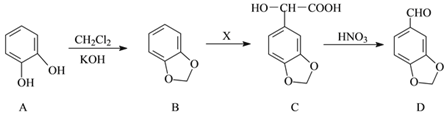
①A→B的反应类型是____________________;C中的含氧官能团名称为_____________________和____________________(填二种)。
②X的分子式为C2H2O3,B→C为加成反应,X的结构简式为____________________。
③芳香化合物Y是D的同分异构体,Y既能与NaHCO3反应生成CO2又能发生银镜反应,苯环上的一硝基取代物只有二种。符合题意的Y的结构简式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,X是主要物质,Y是少量杂质,Z是为除去杂质所要加入的试剂,其中所加试剂正确的组合是 ( )
A | B | C | D | |
X | FeCl2溶液 | FeCl3溶液 | Fe | Na2SO4溶液 |
Y | FeCl3 | CuCl2 | Al | Na2CO3 |
Z | Cu | Fe | NaOH溶液 | BaCl2溶液 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某强酸性溶液X,可能含有Al3+、Ba2+、NH4+、Fe2+、Na+、CO32﹣、SO42﹣、SiO32﹣、NO3﹣中的一种或几种离子,取该溶液进行实验,其现象及转化如下图所示。

请回答下列问题:
(1)由整体的实验过程可判断溶液X中一定不存在的阴离子有______。
(2)产生气体A的离子方程式为____________。
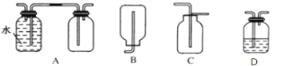
(3)在实验室中收集气体A,可选择如图装置中的______。
(4)写出④反应中生成溶液H的离子方程式____________。
(5)对不能确定是否存在的离子,请简述检测实验方案__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为验证氧化性Cl2>Fe3+>SO2,某小组用如图所示装置进行实验(夹持仪器和A中加热装置已略,气密性已检验)。
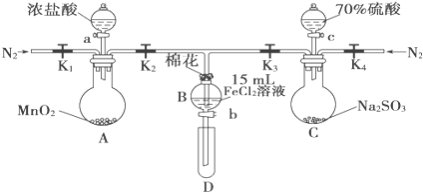
实验过程:
Ⅰ.打开弹簧夹K1~K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K3、K4。
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热。
Ⅲ.当B中溶液变黄时,停止加热,关闭K2。
Ⅳ.打开活塞b,使约2mL的溶液流入D试管中,检验其中的离子。
Ⅴ.打开K3和活塞c,加入70%的硫酸,一段时间后关闭K。
Ⅵ.更新试管D,重复过程Ⅳ,检验B溶液中的离子。
(1)过程Ⅰ的目的是__________________________。
(2)实验室在保存FeCl2溶液时为了防止FeCl2溶液变质,经常向其中加入铁粉,其原因是__________________________。
(3)若向第III步B中的黄色溶液中通入H2S气体,会观察到有淡黄色沉淀生成,写出该反应的化学方程式__________________________。
(4)若将制取的SO2通入硫酸酸化的高锰酸钾溶液可使溶液褪色,其反应的离子方程式为__________________________。
(5)甲、乙、丙三位同学分别完成了上述实验,结论如下表所示.他们的检测结果一定能够证明氧化性Cl2>Fe3+>SO2的是_____(填“甲”、“乙”或“丙”)。
过程Ⅳ,B溶液中含有的离子 | 过程Ⅵ,B溶液中含有的离子 | |
甲 | 有Fe3+无Fe2+ | 有Fe2+ |
乙 | 既有Fe3+又有Fe2+ | 有SO42﹣ |
丙 | 有Fe3+无Fe2+ | 有SO42﹣ |
(6)将B中的FeCl2溶液换成100mLFeBr2溶液并向其中通入2.24LCl2(标准状况下),若溶液中有1/2的Br﹣被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝、氧化铝、氢氧化铝和可溶性铝盐与过量强碱溶液的反应,其生成物有一定的规律,下列说法中正确的是
A.都有H2O生成 B.都有H2生成
C.都有AlO2-生成 D.都有Al3+生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一未知的无色溶液,只可能含有以下离子中的若干种:H+、NH4+、K+、Mg2+、Cu2+、Al3+、NO3-、CO32-、SO42-,现取三份100 mL溶液进行如下实验:
①第一份加入足量AgNO3溶液后,有白色沉淀产生。
②第二份加入足量BaCl2溶液后,有白色沉淀产生,经洗涤、干燥后,沉淀质量为6.99 g。
③第三份逐滴滴加NaOH溶液,测得沉淀与NaOH溶液的体积关系如图所示。
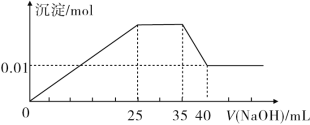
根据上述实验,完成下列问题:
(1)原溶液中一定不存在的离子是______________。
(2)25~35段发生反应的离子方程式为__________。
(3)35~40段发生反应的离子方程式为__________。
(4)实验所加的NaOH的浓度为________。
(5)原溶液中NO3-的物质的量为n(NO3-),根据提供的图像和数据,试计算n(NO3-)的取值范围为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全钒液流电池是一种新型的绿色环保储能电池,工作原理如图所示,a、b均为惰性电极,放电时左槽溶液颜色由黄色变为蓝色。下列叙述正确的是
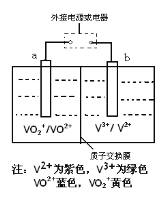
A.充电时右槽溶液颜色由紫色变为绿色
B.放电时,b极发生还原反应
C.充电过程中,a极的反应式为:VO2++2H++e—= VO2+ +H2O
D.电池的总反应可表示为:VO2++V2++2H+ ![]() VO2++V3++H2O
VO2++V3++H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着我国汽车年销量的大幅增加,给空气环境造成了很大的污染。汽车尾气装置里,气体在催化剂表面吸附与解吸作用的过程如图所示,下列说法正确的是( )

A. 反应中NO为氧化剂,N2为氧化产物
B. 汽车尾气的主要污染成分包括CO、NO和N2
C. NO和O2必须在催化剂表面才能反应
D. 催化转化总化学方程式为2NO+O2+4CO ![]() 4CO2+N2
4CO2+N2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com