
【题目】短周期元素A、B、C、D、E原子序数依次增大。A是周期表中原子半径最小的元素,B原子的价电子数等于该元素最低化合价的绝对值,C与D能形成D2C和D2C2两种化合物,而D是同周期中金属性最强的元素,E的负一价离子与C和A形成的某种化合物分子含有相同的电子数。
(1)A、C、D形成的化合物中含有的化学键类型为_______________。
(2)已知:①E-E→2E·;△H=+a kJ·mol-1
② 2A·→A-A;△H=-b kJ·mol-1
③E·+A·→A-E;△H=-c kJ·mol-1(“·”表示形成共价键所提供的电子)
写出298K时,A2与E2反应的热化学方程式____________________________________。
(3)在某温度下、容积均为2L的三个密闭容器中,按不同方式投入反应物,保持恒温恒容,使之发生反应:2A2(g)+BC(g)![]() X(g);△H=-dJ·mol-1(d>0,X为A、B、C三种元素组成的一种化合物)。初始投料与各容器达到平衡时的有关数据如下:
X(g);△H=-dJ·mol-1(d>0,X为A、B、C三种元素组成的一种化合物)。初始投料与各容器达到平衡时的有关数据如下:
实验 | 甲 | 乙 | 丙 |
初始投料 | 2 molA2、1 molBC | 1 molX | 4 molA2、2 molBC |
平衡时n(X) | 0.5mol | n2 | n3 |
反应的能量变化 | 放出Q1kJ | 吸收Q2kJ | 放出Q3kJ |
体系的压强 | P1 | P2 | P3 |
反应物的转化率 | α1 | α2 | α3 |
①在该温度下,假设甲容器从反应开始到平衡所需时间为4 min,则该时间段内A2的平均反应速率v(A2)________。
②该温度下此反应的平衡常数K的值为___________。
③三个容器中的反应分别达平衡时各组数据关系正确的是_______(填序号)。
A.α1+α2=1 B.Q1+Q2=d C.α3<α1
D.P3<2P1=2P2 E.n2<n3<1.0mol F.Q3=2Q1
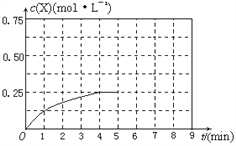
④在其他条件不变的情况下,将甲容器的体系体积压缩到1L,若在第8min达到新的平衡时A2的总转化率为65.5%,请在下图中画出第5min 到新平衡时X的物质的量浓度的变化曲线。_______
【答案】离子键、共价键H2(g)+Cl2(g)=2HCl(g)△H=(a+b-2c)kJ·mol-10.125mol·L-1·min-14ABD
【解析】
A是周期表中原子半径最小的元素,即为H,B是形成化合物种类最多的元素,即为C,C是自然界含量最多的元素,即为O,D是同周期中金属性最强的元素,即为Na,F的负一价离子与C的氢化物分子含有相同的电子数,即为Cl;
(1)A、C、D形成的化合物中含有的化学键类型为:离子键、共价键;
(2)已知①Cl-Cl→2Cl;△H=+akJmol-1
②2H→H-H;△H=-bkJmol-1
③Cl+H→HCl;△H=-ckJmol-1
所以H2(g)+Cl2(g)=2HCl(g)可以是①-②+③×2得到的,所以反应的焓变△H=-(2c-a-b)kJ/mol;
(3)①2H2(g)+CO(g)![]() CH3OH(g);
CH3OH(g);
初始量:2 1 0
变化量:1 0.5 0.5
平衡量:1 0.5 0.5
在该温度下,A2的平均反应速率v(A2)=![]() =0.125molL-1min-1;
=0.125molL-1min-1;
②该温度下,反应2A2(g)+BC(g)![]() X(g)的平衡常数K=
X(g)的平衡常数K=![]() =4mol-2L2;
=4mol-2L2;
③A.投料2molH2、1molCO和1molCH4O建立的平衡是等效的,只是建立的方向不一样,所以α1+α2=1,故A正确;B.料2molH2、1molCO和1molCH3OH建立的平衡是等效的,反应2H2(g)+CO(g)![]() CH3OH(g)是放热的,放出的热量应该是Q1+Q2=a,故B正确;C.当氢气和一氧化碳的投料增加一倍,则压强会增大,导致化学平衡正向移动,移动的结果是反应物的转化率增大,即α3>α1,故C错误;D.投料2molH2、1molCO和1molCH3OH建立的平衡是等效的,所以P1=P2,当氢气和一氧化碳的投料增加一倍,则压强应是增大一倍,但是压强增大,导致化学平衡正向移动,移动的结果是压强比原来的2倍要小,即P3<2P1=2P2,故D正确;E.由D中分析可知,n2=0.5,n3>1.0mol,故E错误;F.当氢气和一氧化碳的投料增加一倍,能量变化数值理论上也应该是原来的2倍,但是压强引起化学平衡正向,而正向放热,结果使得Q3>2Q1,故F错误;选ABD;
CH3OH(g)是放热的,放出的热量应该是Q1+Q2=a,故B正确;C.当氢气和一氧化碳的投料增加一倍,则压强会增大,导致化学平衡正向移动,移动的结果是反应物的转化率增大,即α3>α1,故C错误;D.投料2molH2、1molCO和1molCH3OH建立的平衡是等效的,所以P1=P2,当氢气和一氧化碳的投料增加一倍,则压强应是增大一倍,但是压强增大,导致化学平衡正向移动,移动的结果是压强比原来的2倍要小,即P3<2P1=2P2,故D正确;E.由D中分析可知,n2=0.5,n3>1.0mol,故E错误;F.当氢气和一氧化碳的投料增加一倍,能量变化数值理论上也应该是原来的2倍,但是压强引起化学平衡正向,而正向放热,结果使得Q3>2Q1,故F错误;选ABD;
④将甲容器的体系体积压缩到1L,若在第8min 达到新的平衡时,
2H2(g)+CO(g)![]() CH4O(g)
CH4O(g)
初始量:2 1 0
变化量:1.5 0.75 0.75
平衡量:0.5 0.250.75
所以达到平衡时,甲醇的物质的量浓度是0.75mol/L,在第5min时,由于体积减半,所以甲醇的浓度应该加倍,即为0.25mol/L×2=0.5mol/L,所以5-8min内,甲醇的物质的量浓度从0.5mol/L升高到0.75mol/L,如图所示: 。
。


 小题狂做系列答案
小题狂做系列答案科目:高中化学 来源: 题型:
【题目】溶液中可能含有H+、NH![]() 、Mg2+、Al3+、Fe3+、CO
、Mg2+、Al3+、Fe3+、CO![]() 、SO
、SO![]() 、NO
、NO![]() 中的几种。①加入铝片,产生无色无味的气体;②加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示。则下列说法正确的是( )
中的几种。①加入铝片,产生无色无味的气体;②加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示。则下列说法正确的是( )
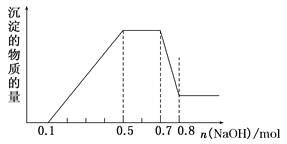
A. 溶液中一定不含CO![]() ,可能含有SO
,可能含有SO![]() 和NO
和NO![]()
B. 在滴加NaOH溶液物质的量为0.5~0.7 mol时,发生的离子反应为:Al3++4OH-===AlO![]() +2H2O
+2H2O
C. 溶液中的阳离子只有H+、Mg2+、Al3+
D. n(H+)∶n(NH![]() )∶n(Mg2+)=2∶4∶1
)∶n(Mg2+)=2∶4∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活、社会密切相关.下列说法中不正确的是( )
A.蛋白质、棉花、PVC,淀粉都是混合物
B.废弃的玻璃、金属、纸制品是可回收利用的资源
C.铁在潮湿的空气中放置,易发生化学腐蚀而生锈
D.用CO2合成聚碳酸酯可降解塑料,实现“碳”的循环利用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿佛加德罗常数的值,下列说法正确的是( )
A. 标准状况下,将6.72L的NO2通入足量的水中转移电子数为0.3NA
B. 常温常压下,22.4LCCl4含有NA个CCl4分子
C. 1 mol Na与足量O2反应,生成Na2O和Na2O2混合物,转移的电子数为NA
D. 18 g D2O所含的电子数为10NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在反应中,元素X的原子将电子转移给元素Y的原子,则下列说法正确的是
①元素X被氧化 ②元素Y被氧化 ③元素X发生还原反应 ④元素Y发生还原反应
A. ①④ B. ③④ C. ②③ D. ①②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,能表示可逆反应2SO2 + O2 ![]() 2SO3 达到化学反应的限度的标志是:① 消耗2 mol SO2的同时生成2 mol SO3② SO2、O2与SO3的物质的量之比为2∶1∶2③ 反应混合物中,SO3的质量分数不再改变 ( )
2SO3 达到化学反应的限度的标志是:① 消耗2 mol SO2的同时生成2 mol SO3② SO2、O2与SO3的物质的量之比为2∶1∶2③ 反应混合物中,SO3的质量分数不再改变 ( )
A.①② B.①③ C.只有③ D.只有①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车安全气囊弹出时的反应为:10NaN3+2KNO3+6SiO2![]() 5Na2SiO3+K2SiO3+16N2↑。下列说法正确的是
5Na2SiO3+K2SiO3+16N2↑。下列说法正确的是
A. 自然界中氮、钠、硅元素均可以游离态形式存在
B. 将反应后的固体溶于适量水,静置,通入CO2,无现象
C. 微粒的半径:r(K+)>r(Na+)>r(O2-)
D. 若反应中转移6.02×1022电子,则消耗NaN3的质量为6.5g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com