
【题目】分离乙酸(沸点118℃)与乙酸乙酯(沸点77.1℃),下列方法中最适宜的是
A.蒸发B.萃取C.过滤D.蒸馏
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:
【题目】叔丁基氯与碱溶液经两步反应得到叔丁基醇,反应(CH3)3CCl+OH-→ (CH3)3COH+Cl-的能量与反应进程如图所示:

下列说法正确的是
A. 该反应为吸热反应
B. (CH3)3C+比(CH3)3 CCl稳定
C. 第一步反应一定比第二步反应快
D. 增大碱的浓度和升高温度均可加快反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定量的稀HNO3中慢慢加入铁粉,得到的Fe2+的物质的量(纵坐标)与所加铁粉的物质的量(横坐标)的关系如图所示。请将正确答案的序号填在相应的横线上。
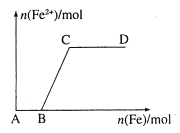
①Fe3+ ②Fe2+ ③Fe、Fe2+ ④Fe2+、Fe3+
(1)AB段铁元素以________形式存在。
(2)BC段铁元素以________形式存在。
(3)CD段铁元素以________形式存在。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知某粒子的结构示意图为: 。请回答:
。请回答:
①当xy=10时,该粒子为________(填“原子”、“阳离子”或“阴离子”)。
②当y=8时,阳离子可能为(填离子符号)________、________。
(2)原子序数大于4的主族元素A和B的离子Am+和Bn它们的核外电子排布相同,据此推断:元素A和B所属周期序数之差为________;元素A和B的原子序数之差为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,将2 molSO2和1molO2充入 10 L恒容密闭容器中,发生反应:2SO2(g) +O2(g)![]() 2SO3(g) △H=-196 kJ·mol-1。5 min时达到平衡,测得反应放热166.6kJ。下列说法错误的是( )
2SO3(g) △H=-196 kJ·mol-1。5 min时达到平衡,测得反应放热166.6kJ。下列说法错误的是( )
A. 0~5min内,用O2表示的平均反应速率v(O2)=0.017 mol·L-1·min-1
B. ![]() 的值不变时,该反应达到平衡状态
的值不变时,该反应达到平衡状态
C. 若增大O2的浓度,SO2的转化率增大
D. 条件不变,若起始时充入4 molSO2和2 molO2,平衡时放出的热量小于333.2 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,表中所列字母分别代表某一化学元素.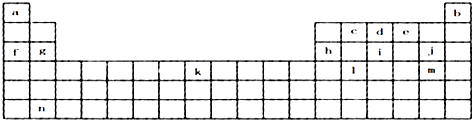
(1)上表所列元素中,原子最外层只有2个电子的短周期元素是(填元素符号);元素j的最高价氧化物的水化物的化学式为 , 元素i最高价氧化物的化学式为 .
(2)比较d、i的氢化物,d的熔沸点较高,原因是
(3)g的离子的结构示意图 , 元素c在周期表的位置
(4)已知与f在同一周期的元素R位于第p主族,以下可用p的代数式表示:则R的原子序数为 , R能形成气态氢化物,其氢化物的化学式为 .
(5)根据构造原理,写出m原子的核外电子排布式
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种元素,其中A元素和B元素的原子都有1个未成对电子,A+比B﹣少一个电子层,B原子得一个电子后3p轨道全满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D的质量分数为40%,且其核内质子数等于中子数.R是由A、D两元素形成的离子化合物,其中A与D离子数之比为2:1.请回答下列问题:
(1)A单质、B单质、化合物R的熔点大小顺序为下列的(填序号)①A单质>B单质>R; ②R>A单质>B单质;
③B单质>R>A单质; ④A单质>R>B单质.
(2)在CB3分子中C元素原子的原子轨道发生的是杂化,其固体时的晶体类型为 .
(3)写出D原子的核外电子排布式 , C的氢化物比D的氢化物在水中溶解度大得多的可能原因 .
(4)如图是D和Fe形成的晶体FeD2最小单元“晶胞”,FeD2晶体中阴、阳离子数之比为 , FeD2物质中具有的化学键类型为 . 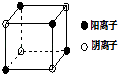
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜及其化合物在生产、生活中有广泛应用,铜在化合物中的常见化合价有+1价、+2 价。已知Cu2O与稀硫酸反应,溶液呈蓝色。
(1)将少量铜丝放入适量的稀硫酸中,温度控制在50℃,加入H2O2,反应一段时间后,升温到60℃,再反应一段时间后可制得硫酸铜,该反应的离子方程式为_______________。温度控制在50℃-60℃的两个原因除了加快反应速率外,还有____________________。在CuSO4溶液中加入一定量的Na2SO3和NaCl 溶液加热,生成CuCl沉淀,写出生成CuCl的离子方程式________________________________。
(2)现向Cu、Cu2O 和CuO组成的混合物中,加入1L 0.6 mol/L HNO3溶液恰好使混合物溶解,同时收集到2240 mL NO 气体(标准状况)。Cu2O跟稀硝酸反应的离子方程式_______________________________。若将上述混合物用足量的H2加热还原,所得到固体的质量为___________g。若混合物中含0.1mol Cu,将该混合物与稀硫酸充分反应,至少消耗H2SO4的物质的量为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由丙烯经下列反应可得到F和 E,E 的分子式为C3H6O3 . 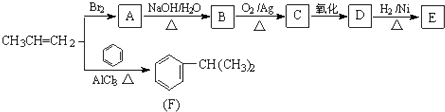
请回答下列问题:
(1)化合物E中所含两种官能团的名称是 .
(2)A→B的反应类型是 , 丙烯→F的反应类型是 .
(3)B转化为C的化学方程式为 .
(4)E的一种同分异构体M具有如下性质:①能发生银镜反应;②1mol M与足量的金属钠反应可产生1mol H2 , 则M的结构简式为 . (已知:同一个碳原子上链接两个羟基不稳定)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com