
【题目】在一定量的稀HNO3中慢慢加入铁粉,得到的Fe2+的物质的量(纵坐标)与所加铁粉的物质的量(横坐标)的关系如图所示。请将正确答案的序号填在相应的横线上。
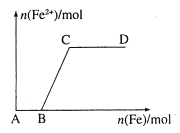
①Fe3+ ②Fe2+ ③Fe、Fe2+ ④Fe2+、Fe3+
(1)AB段铁元素以________形式存在。
(2)BC段铁元素以________形式存在。
(3)CD段铁元素以________形式存在。
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】I、化学上常见的混合物分离或提纯的基本装置如下:

(1)写出仪器名称:a______,b______________。
(2)从海带提取碘的操作如下,除特殊说明外,请在空白处填上上图相应装置中的序号:将干海带进行灼烧,海带灰中含有较多KI,将海带灰溶于水,然后______得到澄清滤液;向滤液中加入硫酸和H2O2混合溶液,得到棕褐色含有单质碘的水溶液。该反应的离子方程式为:______________。向碘的水溶液中加入适量CCl4,进行______操作将上下两层溶液分开。将含有碘的CCl4溶液置于蒸馏烧瓶内进行_____操作,可以粗略从CCl4溶液中分离出碘。
Ⅱ、某同学需用480mL0.5mol/LNa2CO3溶液,在实验室进行配制。
(1)该同学用托盘天平应称量______gNa2CO3粉末,使用容量瓶前必须进行的一步操作是_____。
(2)下图是该同学配制过程的一些关键步骤和操作图。

配制过程的先后顺序为(用字母A--F填写)_______。
(3)步骤A通常称为洗涤,如果没有步骤A,则配得溶液的浓度将_____(填“偏高”、“偏低”、“不变”);步骤F如果俯视刻度线,配得溶液的浓度将______(填“偏高”、“偏低”、“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有某硫酸和硝酸的混合溶液20mL,其中含有硫酸的浓度为2mol·L-1,含硝酸的浓度为
1mol·L-1,现向其中加入0.96g铜粉,充分反应后(假设只生成NO气体),最多可收集到
标准状况下的气体的体积为
A. 89.6mL B. 112mL
C. 168mL D. 224mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中正确的是( )
A. 向硫酸铜溶液中加入过量的NaHS溶液:Cu2++2HS-=CuS↓+H2S↑
B. Fe3O4溶解在过量的稀硝酸中:Fe3O4+8H+=Fe2++2Fe3++4H2O
C. 碳酸氢铵溶液与过量的苛性钾溶液混和共热:NH4++OH-![]() NH3↑+H2O
NH3↑+H2O
D. 将少量SO2气体通入NaClO溶液中:SO2+2ClO-+H2O=SO32-+2HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是分离混合物时常用的仪器,从左至右,可以进行的混合物分离操作分别是( ) 
A.蒸馏、蒸发、萃取、过滤
B.蒸馏、过滤、萃取、蒸发
C.萃取、过滤、蒸馏、蒸发
D.过滤、蒸发、萃取、蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO、CO2是火力发电厂释放出的主要尾气,为减少对环境造成的影响,发电厂试图采用以下方法将其资源化利用,重新获得燃料或重要工业产品。
(1)CO 与Cl2在催化剂的作用下合成光气(COCl2)。某温度下,向2L的密闭容器中投入一定量的CO和Cl2,在催化剂的作用下发生反应:CO(g)+Cl2(g)![]() COCl2(g) ;△H=akJ/mol 反应过程中测定的部分数据如下表:
COCl2(g) ;△H=akJ/mol 反应过程中测定的部分数据如下表:
t/min | n (CO) /mol | n(Cl2)/mol |
0 | 1.20 | 0.60 |
1 | 0.90 | |
2 | 0.80 | |
4 | 0.20 |
①反应1~2min末的平均速率v(COCl2)=________mol/(L·min)。
②在2min~4min间,vCl2正_______vCO逆 (填“>”、“=”或“<”),该温度下K=________。
③已知X、L可分别代表温度或压强,下图表示L一定时,CO的转化率随X的变化关系。
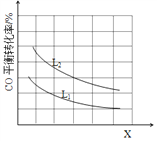
X代表的物理量是___________;a_______0 (填“>”,“=”,“<”)。
(2)在催化剂作用下NO和CO转化为无毒气体:2CO(g) +2NO(g)![]() 2CO2(g) +N2(g);△H=-748kJ·mol-1
2CO2(g) +N2(g);△H=-748kJ·mol-1
①一定条件下,单位时间内不同温度下测定的氮氧化物转化率如图1所示。温度高于710K时,随温度的升高氮氧化物转化率降低的原因可能是________________________________________________。
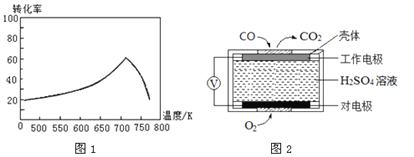
②已知: 测定空气中NO和CO含量常用的方法有两种:
方法1:电化学气敏传感器法。其中CO 传感器的工作原理如图2 所示,则工作电极的反应式为____________。
方法2:氧化还原滴定法。用H2O2溶液吸收尾气、将氮氧化物转化为强酸,用酸碱中和滴定法测定强酸依度。写出NO与H2O2溶液反应的离子方程式:____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com