
����Ŀ��CO��CO2�ǻ������糧�ͷų�����Ҫβ����Ϊ���ٶԻ�����ɵ�Ӱ�죬���糧��ͼ�������·���������Դ�����ã����»��ȼ�ϻ���Ҫ��ҵ��Ʒ��
��1��CO ��Cl2�ڴ����������ºϳɹ���(COCl2)��ij�¶��£���2L���ܱ�������Ͷ��һ������CO��Cl2,�ڴ����������·�����Ӧ��CO(g)+Cl2(g)![]() COCl2(g) ;��H=akJ/mol ��Ӧ�����вⶨ�IJ����������±���
COCl2(g) ;��H=akJ/mol ��Ӧ�����вⶨ�IJ����������±���
t/min | n (CO) /mol | n(Cl2)/mol |
0 | 1.20 | 0.60 |
1 | 0.90 | |
2 | 0.80 | |
4 | 0.20 |
����Ӧ1~2minĩ��ƽ������v(COCl2)=________mol/(L��min)��
����2min~4min�䣬vCl2��_______vCO�� (����>������=������<��)�����¶���K=________��
����֪X��L�ɷֱ�����¶Ȼ�ѹǿ����ͼ��ʾLһ��ʱ��CO��ת������X�ı仯��ϵ��
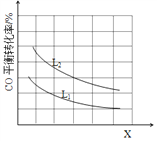
X��������������___________��a_______0 (�>������=������<��)��
��2���ڴ���������NO��COת��Ϊ��������2CO(g) +2NO(g)![]() 2CO2(g) +N2(g);��H=-748kJ��mol-1
2CO2(g) +N2(g);��H=-748kJ��mol-1
��һ�������£���λʱ���ڲ�ͬ�¶��²ⶨ�ĵ�������ת������ͼ1��ʾ���¶ȸ���710Kʱ�����¶ȵ����ߵ�������ת���ʽ��͵�ԭ�������________________________________________________��
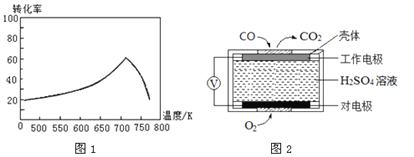
����֪�� �ⶨ������NO��CO�������õķ�����������
����1���绯ѧ������������������CO �������Ĺ���ԭ����ͼ2 ��ʾ�������缫�ķ�ӦʽΪ____________��
����2��������ԭ�ζ�������H2O2��Һ����β��������������ת��Ϊǿ��,������к͵ζ����ⶨǿ�����ȡ�д��NO��H2O2��Һ��Ӧ�����ӷ���ʽ��____________��
���𰸡� 0.05 = 5 �¶� < �¶����ߵ�710Kʱ����Ӧ�ﵽƽ��״̬�����ڸ÷�Ӧ�Ƿ��ȷ�Ӧ�������¶�ƽ�������ƶ�����������ת���ʽ��� CO-2e-+H2O=CO2+2H+ 2NO+3H2O2=2NO3-+2H2O+2H+
����������1��.��.�ɱ������ݿ�֪1~2minĩʱ����n(CO)=0.9mol0.8mol=0.1mol���ɷ���ʽ��֪��n(COCl2)=��n(CO)=0.1mol����v(COCl2)=0.1mol��2L��1min=0.05mol/(L.min)���ʴ�Ϊ��0.05��
��.��4minʱ����Ӧ������Ϊ0.6mol0.2mol=0.4mol���ɷ���ʽ��֪�μӷ�Ӧ��COΪ0.4mol����4minʱCOΪ1.2mol0.4mol=0.8mol����2minʱCO�����ʵ����������2min~4min��÷�Ӧ����ƽ��״̬��vCl2����vCO�����ɷ���ʽ��֪��ƽ��ʱ����COCl2 0.4mol�����¶���ƽ�ⳣ��K=c(COCl2)/c(CO)��c(Cl2)=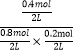 =5���ʴ�Ϊ��=��5��
=5���ʴ�Ϊ��=��5��
��. CO(g)+Cl2(g)![]() COCl2(g)������ӦΪ���������С�ķ�Ӧ������ѹǿƽ�������ƶ���COת��������ͼ����X����ʱ��CO��ƽ��ת���ʽ��ͣ�ƽ�������ƶ�����XΪ�¶ȣ������¶�ƽ�������ƶ���˵������ӦΪ���ȷ�Ӧ����a<0���ʴ�Ϊ���¶ȣ�<��
COCl2(g)������ӦΪ���������С�ķ�Ӧ������ѹǿƽ�������ƶ���COת��������ͼ����X����ʱ��CO��ƽ��ת���ʽ��ͣ�ƽ�������ƶ�����XΪ�¶ȣ������¶�ƽ�������ƶ���˵������ӦΪ���ȷ�Ӧ����a<0���ʴ�Ϊ���¶ȣ�<��
��2��. ��. �ɷ�Ӧ2CO(g)+2NO(g)![]() 2CO2(g)+N2(g) ��H=-748kJ��mol-1��֪���÷�ӦΪ���ȷ�Ӧ�����¶����ߵ�710Kʱ����Ӧ�ﵽƽ��״̬�����ڸ÷�Ӧ�Ƿ��ȷ�Ӧ�������¶���ƽ�������ƶ�����������ת���ʽ��ͣ��ʴ�Ϊ���¶����ߵ�710Kʱ����Ӧ�ﵽƽ��״̬�����ڸ÷�Ӧ�Ƿ��ȷ�Ӧ�������¶���ƽ�������ƶ�����������ת���ʽ��ͣ�
2CO2(g)+N2(g) ��H=-748kJ��mol-1��֪���÷�ӦΪ���ȷ�Ӧ�����¶����ߵ�710Kʱ����Ӧ�ﵽƽ��״̬�����ڸ÷�Ӧ�Ƿ��ȷ�Ӧ�������¶���ƽ�������ƶ�����������ת���ʽ��ͣ��ʴ�Ϊ���¶����ߵ�710Kʱ����Ӧ�ﵽƽ��״̬�����ڸ÷�Ӧ�Ƿ��ȷ�Ӧ�������¶���ƽ�������ƶ�����������ת���ʽ��ͣ�
��. ����1����ͼ��֪����װ����ԭ���װ�ã�ͨ���CO����CO2��̼Ԫ�صĻ��ϼ����߷���������Ӧ����ͨ��CO�ĵ缫�Ǹ������ڸ�����COʧ���ӷ���������Ӧ���缫��ӦʽΪ��CO2e+H2O�TCO2+2H+���ʴ�Ϊ��CO2e+H2O�TCO2+2H+��
����2��NO��H2O2��Һ������ǿ��������˫��ˮ����ԭ��ˮ����Ӧ�����ӷ���ʽΪ��2NO+3H2O2�T2NO3+2H2O+2H+���ʴ�Ϊ��2NO+3H2O2�T2NO3+2H2O+2H+��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ������ϡHNO3�������������ۣ��õ���Fe2+�����ʵ����������꣩���������۵����ʵ����������꣩�Ĺ�ϵ��ͼ��ʾ���뽫��ȷ�𰸵����������Ӧ�ĺ����ϡ�
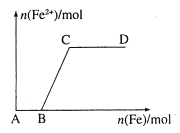
��Fe3+ ��Fe2+ ��Fe��Fe2+ ��Fe2+��Fe3+
(1)AB����Ԫ����________��ʽ���ڡ�
(2)BC����Ԫ����________��ʽ���ڡ�
(3)CD����Ԫ����________��ʽ���ڡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����A��B��C��D����Ԫ�أ�����AԪ�غ�BԪ�ص�ԭ�Ӷ���1��δ�ɶԵ��ӣ�A+��B����һ�����Ӳ㣬Bԭ�ӵ�һ�����Ӻ�3p���ȫ����Cԭ�ӵ�p�������3��δ�ɶԵ��ӣ�����̬�⻯����ˮ�е��ܽ����ͬ��Ԫ�����γɵ��⻯�������D������ϼۺ���ͻ��ϼ۵Ĵ�����Ϊ4��������������к�D����������Ϊ40%���������������������������R����A��D��Ԫ���γɵ����ӻ��������A��D������֮��Ϊ2��1����ش��������⣺
��1��A���ʡ�B���ʡ�������R���۵��С˳��Ϊ���е�������ţ���A���ʣ�B���ʣ�R�� ��R��A���ʣ�B���ʣ�
��B���ʣ�R��A���ʣ� ��A���ʣ�R��B���ʣ�
��2����CB3������CԪ��ԭ�ӵ�ԭ�ӹ�����������ӻ��������ʱ�ľ�������Ϊ ��
��3��д��Dԭ�ӵĺ�������Ų�ʽ �� C���⻯���D���⻯����ˮ���ܽ�ȴ�ö�Ŀ���ԭ�� ��
��4����ͼ��D��Fe�γɵľ���FeD2��С��Ԫ����������FeD2������������������֮��Ϊ �� FeD2�����о��еĻ�ѧ������Ϊ �� 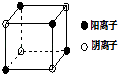
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͭ���仯�������������������й㷺Ӧ�ã�ͭ�ڻ������еij������ϼ���+1�ۡ�+2 �ۡ���֪Cu2O��ϡ���ᷴӦ����Һ����ɫ��
��1��������ͭ˿����������ϡ�����У��¶ȿ�����50��,����H2O2,��Ӧһ��ʱ������µ�60�����ٷ�Ӧһ��ʱ�����Ƶ�����ͭ���÷�Ӧ�����ӷ���ʽΪ_______________���¶ȿ�����50��-60��������ԭ����˼ӿ췴Ӧ�����⣬����____________________����CuSO4��Һ�м���һ������Na2SO3��NaCl ��Һ���ȣ�����CuCl������д������CuCl�����ӷ���ʽ________________________________��
��2������Cu��Cu2O ��CuO��ɵĻ�����У�����1L 0.6 mol/L HNO3��Һǡ��ʹ������ܽ⣬ͬʱ�ռ���2240 mL NO ����(��״��)��Cu2O��ϡ���ᷴӦ�����ӷ���ʽ_______________________________�����������������������H2���Ȼ�ԭ�����õ����������Ϊ___________g����������к�0.1mol Cu,���û������ϡ�����ַ�Ӧ����������H2SO4�����ʵ���Ϊ_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�������л���ķ���ʽΪC8H6O2 �� ���ķ��ӣ��������ⲻ�����������п����У� ��
A.�����ǻ�
B.һ������
C.����ȩ��
D.һ���Ȼ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и�����������Һ���ܴ���������ǣ� ��
A.H����SO42-��NO3-��Fe2��
B.Mg2����Cl����NO3-��OH��
C.Ba2����Na����CO32-��NO3-
D.Na����Al3����Cl����SO42-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�ܱ�������ͨ��A��B��C�������壬����һ���¶ȣ���t1~t4 sʱ��ø����ʵ�Ũ��������������ж���ȷ����
���� �ⶨʱ��/s Ũ�� | t1 | t2 | t3 | t4 |
c(A)/(mol��L1) | 6 | 3 | 2 | 2 |
c(B)/(mol��L1) | 5 | 3.5 | 3 | 3 |
c(C)/(mol��L1) | 1 | 2.5 | 3 | 3 |
A����t3 sʱ��Ӧ�Ѿ�ֹͣ
B��t3~t4 s�������淴Ӧ���ʲ����
C���������з����ķ�ӦΪA(g)+B(g)![]() C(g)
C(g)
D����t2~t3 s��A��ƽ����Ӧ����Ϊ![]() mol��L1��s1
mol��L1��s1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ɱ�ϩ�����з�Ӧ�ɵõ�F�� E��E �ķ���ʽΪC3H6O3 �� 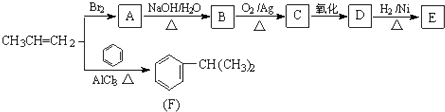
��ش��������⣺
��1��������E���������ֹ����ŵ������� ��
��2��A��B�ķ�Ӧ������ �� ��ϩ��F�ķ�Ӧ������ ��
��3��Bת��ΪC�Ļ�ѧ����ʽΪ ��
��4��E��һ��ͬ���칹��M�����������ʣ����ܷ���������Ӧ����1mol M�������Ľ����Ʒ�Ӧ�ɲ���1mol H2 �� ��M�Ľṹ��ʽΪ �� ����֪��ͬһ��̼ԭ�������������ǻ����ȶ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������Լ���ơ������Լ���������±���������þ����ˮ���������õõ��ģ��磺CH3CH2Br+Mg ![]() CH3CH2MgBr���������ʻ������ӳɷ�Ӧ�����еġ���MgBr�����ּӵ��ʻ������ϣ����ò��ᆳˮ��ɵô�������ͨ��������Ӧ�ϳ�2������ѡ�õ��л�ԭ����ȷ��һ���ǣ� ��
CH3CH2MgBr���������ʻ������ӳɷ�Ӧ�����еġ���MgBr�����ּӵ��ʻ������ϣ����ò��ᆳˮ��ɵô�������ͨ��������Ӧ�ϳ�2������ѡ�õ��л�ԭ����ȷ��һ���ǣ� ��
A.������ͼ�ȩ
B.������ͱ�ȩ
C.һ�ȼ���ͱ�ͪ
D.һ�ȼ������ȩ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com