
【题目】完成下列填空。
(1)25℃时,已知 0.1mol·L-1 CH3COOH 溶液的 pH=3,其电离度为__,由水电离的c(H+)=__。
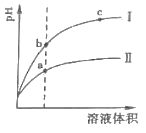
(2)相同 pH的 CH3COOH溶液和 HCl溶液加水稀释,其 pH变化情况如曲线I、II所示,其中表示 HCl溶液的是曲线__,a、b两点中,导电能力更强的是__。
(3)氨水和盐酸等浓度等体积混合后,溶液呈酸性的原因是(用离子方程式表示)__。此时,该混合溶液中离子浓度由大到小的顺序为___。
【答案】1% 1×10—11mol·L—1 I a NH4++H2O![]() NH3·H2O+H+ c(Cl—)>c(NH4+)>c(H+)>c(OH—)
NH3·H2O+H+ c(Cl—)>c(NH4+)>c(H+)>c(OH—)
【解析】
(1)根据电离度![]() =
=![]() ×100%,进行计算;
×100%,进行计算;
(2)相同 pH的 CH3COOH溶液和 HCl溶液,加水稀释促进CH3COOH电离,因此稀释相同倍数后盐酸pH的变化大于醋酸,由此进行分析;
(3)氨水和盐酸等浓度等体积混合,铵根离子发生水解,使溶液显酸性,再结合电荷守恒判断离子浓度大小的关系。
(1)醋酸的电离方程式为CH3COOH![]() CH3COO-+H+,c(H+)=c(CH3COO-),0.1mol·L-1 CH3COOH 溶液的 pH=3,那么已电离的醋酸分子为10-3mol/L,则有电离度
CH3COO-+H+,c(H+)=c(CH3COO-),0.1mol·L-1 CH3COOH 溶液的 pH=3,那么已电离的醋酸分子为10-3mol/L,则有电离度![]() =
=![]() ×100%=
×100%=![]() ×100%=1%;
×100%=1%;
CH3COOH 溶液的 pH=3,有c(H+)=10-3mol/L,由水电离出的c(OH-)=![]() =10-11mol/L;
=10-11mol/L;
(2)相同 pH的 CH3COOH溶液和 HCl溶液,加水稀释促进CH3COOH电离,因此稀释相同倍数后盐酸pH的变化大于醋酸,所以图中曲线I为盐酸,II为醋酸;溶液的导电能力与离子浓度成正比,c(H+)越大,pH越小,因此溶液导电能力较大的是a;
(3)氨水和盐酸等浓度等体积混合,铵根离子发生水解,使溶液显酸性,水解方程式为:NH4++H2O![]() NH3·H2O+H+;由于铵根离子发生水解,有c(Cl-)>c(NH4+),又因NH4+水解后使溶液显酸性,有c(H+)>c(OH-),因此溶液中离子浓度由大到小的顺序为:c(Cl—)>c(NH4+)>c(H+)>c(OH—)。
NH3·H2O+H+;由于铵根离子发生水解,有c(Cl-)>c(NH4+),又因NH4+水解后使溶液显酸性,有c(H+)>c(OH-),因此溶液中离子浓度由大到小的顺序为:c(Cl—)>c(NH4+)>c(H+)>c(OH—)。


 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:
【题目】①C(s)+O2(g)![]() CO2(g) ΔH=-393.5kJ/mol
CO2(g) ΔH=-393.5kJ/mol
②2H2(g)+O2(g)![]() 2H2O(1) ΔH=-571.6kJ/mol
2H2O(1) ΔH=-571.6kJ/mol
现在0.2mol炭粉和氢气组成的悬浮气,在氧气中完全燃烧,共放出67.93kJ的热量,则混合物中C与H2物质的量之比为
A.1︰1 B.1︰2 C.2︰3 D.3︰2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.2SO2(g)+O2(g)![]() 2SO3(g),反应过程的能量变化如图所示:
2SO3(g),反应过程的能量变化如图所示:
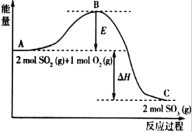
已知2mol SO2(g)和O2(g)反应生成为1mol SO3(g)的ΔΗ=-99kJ·mol-1,请回答下列问题。
(1)该反应通常用V2O5作催化剂,加V2O5会使图中B点_______ (填“升高”或“降低”)。
(2)图中ΔΗ= __________。
(3)如果反应速率v(SO2)为0.05mol·L-1·min-1,则v(O2)= _______。
Ⅱ.已知下列热化学方程式:
①H2O(l)===H2(g)+![]() O2(g)ΔH=+285.8 kJ/mol
O2(g)ΔH=+285.8 kJ/mol
②H2(g)+![]() O2(g)===H2O(g)ΔH=-241.8 kJ/mol
O2(g)===H2O(g)ΔH=-241.8 kJ/mol
③NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH=-57.3 kJ/mol
④C(s)+![]() O2(g)===CO(g) ΔH=-110.5 kJ/mol
O2(g)===CO(g) ΔH=-110.5 kJ/mol
⑤C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ/mol
回答下列问题:
(1)上述反应中属于吸热反应的是___________;
(2)燃烧10 g H2生成液态水,放出的热量为__________;
(3)写出CO燃烧的热化学方程式__________;
(4)写出制水煤气的热化学方程式_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为检验一批因露置而部分变质的Ba(OH)2药品的成分,某化学探究性学习小组设计了方案对其进行将20.45g药品分成五等分,逐渐加入100mL1 mol/L的盐酸中,并充分搅拌,测得生成气体的体积(已换算为标准状况下)、剩余固体的量与固体加入量的关系如图所示。考虑到某地附近为硫酸工业区,该小组同学判断此药品可能含三或四种成分。

(1) 写出硫酸工业尾气与过量的Ba(OH)2反应的离子方程式:________________________
(2)提出以下三种合理假设:(已知在空气中Ba(OH)2很难生成酸式盐)
假设一:药品成分为Ba(OH)2和BaSO4、BaSO3;
假设二:药品成分为Ba(OH)2和________________;
假设三:药品成分为Ba(OH)2和________________。
(3)实验验证:为确定该药品的成分,该小组利用上述实验中生成的气体,选择适当的试剂进行探究,请设计合理方案填入下表:
实验操作 | 预期实验现象和结论 |
| 若____________________,假设一成立; |
(4)问题讨论:若经试验验证,此药品为四种成分混合物,该小组同学认为由上述曲线可知,当所加固体质量为12.27 g时,药品成分与盐酸刚好完全反应,你认为该组同学的判断是否正确______。(填“是”或者“否”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生研究小组欲探究CuSO4溶液与Na2CO3溶液混合产生的蓝绿色沉淀组成,小组进行下列实验探究。
【提出假设】
假设1:沉淀为Cu(OH)2
假设2:沉淀为
假设3:沉淀为碱式碳酸铜[化学式可表示为nCuCO3mCu(OH)2]
【查阅资料】无论是哪一种沉淀受热均易分解(假设均不含结晶水)。
【物质成分探究】
步骤1:将所得悬浊液过滤,用蒸馏水洗涤,再用无水乙醇洗涤
步骤2:甲同学取一定量固体,用气密性良好的右图装置(夹持仪器未画出)进行定性实验。

请回答下列问题:
(1)假设2中的沉淀为 。
(2)假设1中沉淀为Cu(OH)2的理论依据是 。
(3)无水乙醇洗涤的目的____ __。
(4)若反应后A中蓝绿色固体变黑,C中无明显现象,证明假设______(填写序号)成立。
(5)乙同学认为只要将上图中B装置的试剂改用 试剂后,便可验证上述所有假设。
(6)乙同学更换B试剂后验证假设3成立的实验现象是 。
(7)在假设3成立的前提下,某同学考虑用Ba(OH)2代替Ca(OH)2,测定蓝绿色固体的化学式,若所取蓝绿色固体质量为27.1g,实验结束后装置B的质量增加2.7g,C中的产生沉淀的质量为19.7g。则该蓝绿色固体的化学式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
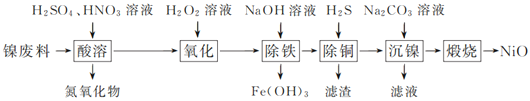
【题目】以镍废料(主要成分为镍铁合金,含少量铜)为原料,生产NiO的部分工艺流程如下:
已知:下表列出了几种金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
Ni2+ | Fe2+ | Fe3+ | Cu3+ | |
开始沉淀pH | 6.2 | 7.6 | 2.3 | 4.2 |
沉淀完全pH | 8.5 | 9.1 | 3.2 | 5.6 |
(1) “酸溶”时Ni转化为NiSO4,该过程中温度控制在70~80 ℃的原因是________________。
(2) “氧化”时,Fe2+参加反应的离子方程式为___________________________________。
(3) “除铁”时需控制溶液的pH范围为________。
(4) “滤渣”的主要成分为___________(填化学式)。
(5) “沉镍”时得到碱式碳酸镍[用xNiCO3·yNi(OH)2表示]沉淀。
①在隔绝空气条件下,“煅烧”碱式碳酸镍得到NiO,该反应的化学方程式为___________________。
②“沉镍”时,溶液pH增大,碱式碳酸镍中Ni元素含量会增加,原因是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2是廉价的碳资源,其综合利用具有重要意义。
(1)CO2与CH4经催化重整反应CH4(g)+CO2(g)2CO(g)+2H2(g)△H=+120kJ·mol-1可以制得合成气。
已知上述反应中相关物质所含化学键键能数据如下:
化学键 | C-H | C=O | H-H | C≡O(CO) |
键能/kJ·mol-1 | a | b | c | x |
①x=___。
②分别在恒温密闭容器A(恒容)、B(恒压,体积可变)中,加入CH4和CO2各1mol的混合气体,起始体积均为VL。相同温度下两容器中反应达平衡后吸收热量较多的是___ (填“A”或“B”)。保持A容器的体积和B容器压强不变,写出一种能使A、B两容器中各物质的体积分数相同的方法:___。
③某温度下,在体积为2L的恒容密闭容器中加入2molCH4、1molCO2以及催化剂进行反应,达到平衡时CO2的体积分数为![]() ,该温度下反应的平衡常数为___。
,该温度下反应的平衡常数为___。
(2)CO2可以被NaOH捕获。所得溶液中含碳微粒的分布百分数随pH的变化如图所示。H2CO3的二级电离平衡常数Ka2=___。pH=5.4时,φ(A):φ(B)=___。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定质量的甲烷燃烧后得到的产物为CO、CO2和水蒸气,此混合气体质量为49.6g,当其缓慢经过无水CaCl2时,CaCl2增重25.2g,原混合气体中CO2的质量为( )
A.12.5gB.13.2gC.19.7gD.24.4g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组设计用铁粉将NO还原为N2(同时生成FeO),下列说法不正确的是
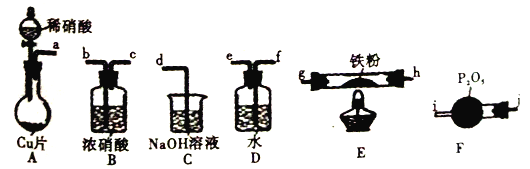
已知:①浓硝酸可氧化NO;②NaOH溶液能吸收NO2,不吸收NO。
A. 装置的连接顺序为a![]() f
f![]() e
e![]() j
j![]() i
i![]() h
h![]() g(或g
g(或g![]() h)
h)![]() b
b![]() c
c![]() d
d
B. 装置E中发生的化学方程式为2NO+2Fe![]() 2FeO+N2
2FeO+N2
C. 装置D的作用是吸收挥发出来的硝酸和产生NO2
D. 装置B的作用是干燥,防止水蒸气进入E中干扰反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com