
【题目】Ⅰ.2SO2(g)+O2(g)![]() 2SO3(g),反应过程的能量变化如图所示:
2SO3(g),反应过程的能量变化如图所示:
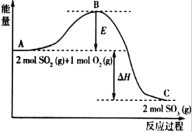
已知2mol SO2(g)和O2(g)反应生成为1mol SO3(g)的ΔΗ=-99kJ·mol-1,请回答下列问题。
(1)该反应通常用V2O5作催化剂,加V2O5会使图中B点_______ (填“升高”或“降低”)。
(2)图中ΔΗ= __________。
(3)如果反应速率v(SO2)为0.05mol·L-1·min-1,则v(O2)= _______。
Ⅱ.已知下列热化学方程式:
①H2O(l)===H2(g)+![]() O2(g)ΔH=+285.8 kJ/mol
O2(g)ΔH=+285.8 kJ/mol
②H2(g)+![]() O2(g)===H2O(g)ΔH=-241.8 kJ/mol
O2(g)===H2O(g)ΔH=-241.8 kJ/mol
③NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH=-57.3 kJ/mol
④C(s)+![]() O2(g)===CO(g) ΔH=-110.5 kJ/mol
O2(g)===CO(g) ΔH=-110.5 kJ/mol
⑤C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ/mol
回答下列问题:
(1)上述反应中属于吸热反应的是___________;
(2)燃烧10 g H2生成液态水,放出的热量为__________;
(3)写出CO燃烧的热化学方程式__________;
(4)写出制水煤气的热化学方程式_____________。
【答案】降低 -198 kJ·mol-1 0.025 mol·L-1·min-1 ① 1429 kJ CO(g)+![]() O2(g)===CO2(g) ΔH=-283 kJ/mol C(s)+H2O(g)===CO(g)+H2(g) ΔH=+131.3 kJ/mol
O2(g)===CO2(g) ΔH=-283 kJ/mol C(s)+H2O(g)===CO(g)+H2(g) ΔH=+131.3 kJ/mol
【解析】
I.由图可知,2SO2(g)+O2(g)=2SO3(g)为放热反应,加入催化剂,活化能减小,反应反应热不变,根据反应2SO2(g)+O2(g)=2SO3(g)结合1mol SO2氧化为1mol SO3的△H=-99kJmol-1计算反应热;
II.主要是盖斯定律的应用,先写出目标反应的方程式,再得出方程式的运算式,最后计算反应热。
I(1)因图中A、C分别表示反应物总能量、生成物总能量,E为活化能,活化能的大小与反应热无关,加入催化剂,活化能减小即E减小,故B点降低,故答案为:降低;
(2)因1mol SO2(g)氧化为1mol SO3的 △H=-99kJmol-1,所以2molSO2(g)氧化为2molSO3的△H=-198kJmol-1,则2SO2(g)+O2(g)=2SO3(g)△H=-198KJmol-1,故答案为:-198;
(3)速率之比等于计量数之比,v(SO2)为0.05mol·L-1·min-1,则v(O2)= 0.025 mol·L-1·min-1,故答案为:0.025 mol·L-1·min-1;
II(1)由△H>0时为吸热反应可知,②③④⑤为放热反应,①为吸热反应,故答案为:①;
(2)①H2O(l)===H2(g)+![]() O2(g)ΔH=+285.8 kJ/mol,则燃烧10gH2即5molH2时,放热为285.8kJ/mol×5mol=1429kJ,故答案为:1429kJ;
O2(g)ΔH=+285.8 kJ/mol,则燃烧10gH2即5molH2时,放热为285.8kJ/mol×5mol=1429kJ,故答案为:1429kJ;
(3)CO燃烧的化学方程式为:CO(g)+![]() O2(g)=CO2(g),
O2(g)=CO2(g),
④C(s)+![]() O2(g)===CO(g) ΔH=-110.5 kJ/mol
O2(g)===CO(g) ΔH=-110.5 kJ/mol
⑤C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ/mol
由盖斯定律,⑤-④得CO(g)+![]() O2(g)=CO2(g),故ΔH=-393.5 kJ/mol-(-110.5 kJ/mol)=-283 kJ/mol,故答案为:CO(g)+
O2(g)=CO2(g),故ΔH=-393.5 kJ/mol-(-110.5 kJ/mol)=-283 kJ/mol,故答案为:CO(g)+![]() O2(g)===CO2(g) ΔH=-283 kJ/mol;
O2(g)===CO2(g) ΔH=-283 kJ/mol;
(4)制水煤气的化学方程式C(s)+H2O(g)===CO(g)+H2(g),
②H2(g)+![]() O2(g)===H2O(g)ΔH=-241.8 kJ/mol
O2(g)===H2O(g)ΔH=-241.8 kJ/mol
④C(s)+![]() O2(g)===CO(g) ΔH=-110.5 kJ/mol
O2(g)===CO(g) ΔH=-110.5 kJ/mol
由盖斯定律,④-②得C(s)+H2O(g)===CO(g)+H2(g),故ΔH=-110.5 kJ/mol-(-241.8 kJ/mol)=+131.3 kJ/mol,故答案为:C(s)+H2O(g)===CO(g)+H2(g) ΔH=+131.3 kJ/mol。


 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源: 题型:
【题目】已知白磷和P4O6的分子结构如图所示,又知化学键的键能是形成(或断开)1 mol化学键时释放(或吸收)的能量,现查知P—P键能为198 kJ·mol-1、P—O键能为360 kJ·mol-1、O===O键能为498 kJ·mol-1。若生成1 mol P4O6,则反应P4(白磷)+3O2=P4O6中的能量变化为( )
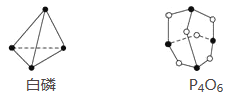
A. 吸收1 638 kJ能量 B. 放出1 638 kJ能量
C. 吸收126 kJ能量 D. 放出126 kJ能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2H2(g)+O2(g)═2H2O(l) △H= -571.6kJmol-1
2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l) △H= -1452kJmol-1
H+(aq)+OH-(aq)═H2O(l) △H= -57.3kJmol-1
下列说法正确的是
A.H2(g)的燃烧热为571.6kJmol-1
B.![]() H2SO4(aq)+
H2SO4(aq)+![]() Ba(OH)2(aq)═
Ba(OH)2(aq)═![]() BaSO4(s)+H2O(l) △H=-57.3kJmol-1
BaSO4(s)+H2O(l) △H=-57.3kJmol-1
C.同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多
D.3H2(g)+CO2(g)═CH3OH(l)+H2O(l) △H=+131.4kJmol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以玉米(主要成分是淀粉)为原料制备乙醇的流程如下
![]()
下列说法不正确的是( )。
A.C12H22O11属于二糖B.1mol葡萄糖可分解成3mol乙醇
C.可用碘水检验淀粉是否完全水解D.不能用分液操作分离乙醇和水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物A经李比希法测得其中含碳的质量分数为72.0%、含氢的质量分数为6.67%,其余为氧,质谱法分析得知A的相对分子质量为150。现代仪器分析有机化合物的分子结构有以下两种方法。
方法一:核磁共振仪可以测定有机物分子里不同化学环境的氢原子及其相对数量,如乙醇(CH3CH2OH)的1H核磁共振谱有3个峰,其峰面积之比为3∶2∶1。现测出A的1H核磁共振谱有5个峰,其峰面积之比为1∶2∶2∶2∶3。
方法二:利用红外光谱仪可初步检测有机化合物中的某些基团,现测得A分子的红外光谱如图所示。
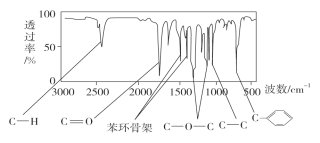
已知:A分子中只含一个苯环,且苯环上只有一个取代基。试回答下列问题:
(1)A的分子式:________。
(2)A的结构简式:__________________(任写一种)。
(3)A的芳香类同分异构体有多种,请按要求写出其结构简式。
①分子中不含甲基的芳香酸:_____________________;
②遇FeCl3显紫色且苯环上只有两个取代基的芳香醛:________________(任写一种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取一支硬质大试管,通过排饱和食盐水的方法先后收集半试管甲烷和半试管氯气,并置于光亮处(如图),下列对于试管内发生的反应及现象的说法正确的是( )
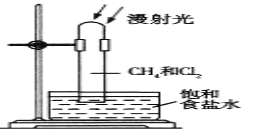
A. 反应过程中试管内黄绿色逐渐变浅,试管壁上有油珠产生
B. 将该装置放在黑暗处,![]() 与
与![]() 也能反应
也能反应
C. 该反应仅得到一种有机产物
D. ![]() 和
和![]() 完全反应后液面上升,液体充满试管
完全反应后液面上升,液体充满试管
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaNO2是一种白色易溶于水的固体,溶液呈碱性,其外观与氯化钠相似,有咸味,俗称工业盐;是一 种重要的化学试剂、漂白剂和食品添加剂。已知亚硝酸盐能被溴水氧化,在酸性条件下能氧化亚铁离子; 亚硝酸银是可溶于稀硝酸的白色沉淀。
请完成以下填空:
(1)N原子最外层电子的轨道排布式为_______;用一个事实说明氮和氧非金属强弱_______。
(2)酸性条件下,NaNO2溶液只能将I-氧化为I2,同时生成NO。写出此反应①的离子方程式并标出电子转移的方向和数目______。
(3)氯气、浓硝酸、酸性高锰酸钾等都是常用的强氧化剂,工业上氧化卤水中的I-提取单质I2选择了价格并不便宜的亚硝酸钠,可能的原因是_______。
(4)在盐酸溶液中加入亚硝酸钠溶液至中性,则c(Cl-)_____c(HNO2)(填“<”、“>”或“=”)。
(5)设计一种鉴别亚硝酸钠和氯化钠的实验方案。_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列填空。
(1)25℃时,已知 0.1mol·L-1 CH3COOH 溶液的 pH=3,其电离度为__,由水电离的c(H+)=__。
(2)相同 pH的 CH3COOH溶液和 HCl溶液加水稀释,其 pH变化情况如曲线I、II所示,其中表示 HCl溶液的是曲线__,a、b两点中,导电能力更强的是__。
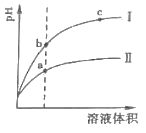
(3)氨水和盐酸等浓度等体积混合后,溶液呈酸性的原因是(用离子方程式表示)__。此时,该混合溶液中离子浓度由大到小的顺序为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用来减轻感冒症状的布洛芬的结构简式如图所示,下列有关说法不正确的是
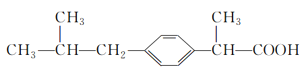
A.1mol布洛芬能与足量NaHCO3溶液反应最多生成1molCO2
B.布洛芬的分子式为C13H18O2
C.布洛芬苯环上的一溴代物有2种
D.布洛芬能发生氧化、取代、加成和缩聚反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com