
【题目】以玉米(主要成分是淀粉)为原料制备乙醇的流程如下
![]()
下列说法不正确的是( )。
A.C12H22O11属于二糖B.1mol葡萄糖可分解成3mol乙醇
C.可用碘水检验淀粉是否完全水解D.不能用分液操作分离乙醇和水
【答案】B
【解析】
由流程图可知:玉米淀粉在酸性条件下水解得到C12H22O11,C12H22O11在酸性条件下继续水解得到葡萄糖,葡萄糖在酒化酶的作用下转化为乙醇,根据C12H22O11的分子式以及糖类的定义,可知C12H22O11属于二糖,据此进行分析判断。
A.由题意可知,C12H22O11属于二糖,A项正确;
B.葡萄糖转化为乙醇的化学反应方程式为:![]() ,1mol葡萄糖分解成2mol乙醇,故B项错误;
,1mol葡萄糖分解成2mol乙醇,故B项错误;
C.根据淀粉遇碘变蓝,可取少许水解液于试管中,若滴加碘水,无明显变化,则证明淀粉已水解完全,即可用碘水检验淀粉是否完全水解,C项正确;
D.乙醇和水互溶,不可用分液操作分离,D项正确。
答案选B。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】用惰性电极电解足量下列溶液一段时间后,再加入一定量括号内的纯净物,能使溶液恢复到原来的成分和浓度的是
A. AgNO3[AgNO3] B. NaOH[NaOH] C. KCl[H2O] D. CuSO4[CuO]
【答案】D
【解析】石墨电极为惰性电极,溶液中阳离子在阴极放电,阴离子在阳极放电。A、电解AgNO3溶液,Ag+在阴极放电生成Ag,OH-在阳极放电生成O2,且n(Ag)∶n(O2)=2∶1,则应加入Ag2O恢复浓度,故A错误;B、电解NaOH溶液,H+在阴极放电生成H2,OH-在阳极放电生成O2,且n(H2)∶n(O2)=2∶1,则应加入一定量的H2O恢复原样,故B错误;C、电解KCl溶液,H+在阴极放电生成H2,Cl-在阳极放电生成Cl2,且n(H2)∶n(Cl2)=1∶1,则应加入一定量HCl恢复原样,故C错误;D、电解CuSO4溶液,Cu2+在阴极放电生成Cu,OH-在阳极放电生成O2,且n(Cu)∶n(O2)=2∶1,则应加入一定量CuO恢复原样,故D正确。故选D。
点睛:分析电解反应的原理,在两极析出什么物质(固体或气体),相当于什么物质脱离反应体系,根据元素守恒和原子比例,加入对应的物质,即可使溶液完全复原。
【题型】单选题
【结束】
28
【题目】工业上用电解法处理含镍酸性废水并得到单质Ni的原理如图所示。下列说法不正确的是
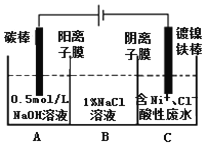
已知:①Ni2+在弱酸性溶液中发生水解
②氧化性:Ni2+(高浓度)>H+>Ni2+(低浓度)
A. 碳棒上发生的电极反应:4OH--4e-=O2↑+2H2O
B. 电解过程中,B中NaCl溶液的物质的量浓度将不断减少
C. 为了提高Ni的产率,电解过程中需要控制废水pH
D. 若将图中阳离子膜去掉,将A、B两室合并,则电解反应总方程式发生改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】①C(s)+O2(g)![]() CO2(g) ΔH=-393.5kJ/mol
CO2(g) ΔH=-393.5kJ/mol
②2H2(g)+O2(g)![]() 2H2O(1) ΔH=-571.6kJ/mol
2H2O(1) ΔH=-571.6kJ/mol
现在0.2mol炭粉和氢气组成的悬浮气,在氧气中完全燃烧,共放出67.93kJ的热量,则混合物中C与H2物质的量之比为
A.1︰1 B.1︰2 C.2︰3 D.3︰2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(I)苹果酸(![]() )常用于汽水、糖果的添加剂。
)常用于汽水、糖果的添加剂。
(1)写出苹果酸中官能团的名称___________________
(2)写出苹果酸分别与下列物质反应的化学方程式①Na_______________
②Na2CO3______________________________
(3)写出其一分子内酯化成四元环酯的结构简式:_______________。
(II)(4)如图是辛烷的一种结构M(只画出了碳架,没有画出氢原子)按下列要求,回答问题:
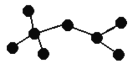
①用系统命名法命名________。
②M的一氯代物有________种。
③M是由某烯烃加成生成的产物,则该烯烃可能有_______种结构。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.反应A(g)2B(g)△H,若正反应的活化能为EakJ·mol-l,逆反应的活化能为EbkJ·mol-l,则△H=-(Ea-Eb)kJ·mol-l
B.某温度下,氯化钠在水中的溶解度是20g,则该温度下的饱和氯化钠溶液溶质的质量分数为20%
C.将0.2mol·L-1的CH3COOH溶液与0.1mol·L-1的NaOH溶液等体积混合后,溶液中有关粒子的浓度满足下列关系:2c(H+)-c(OH-)=c(CH3COO-)-c(CH3COOH)
D.将浓度为0.1mol·L-1HF溶液加水不断稀释过程中,电离平衡常数Ka(HF)保持不变,![]() 始终保持增大
始终保持增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以玉米为原料进行综合利用,可以提高经济效益,减少对环境的污染。如图所示为用玉米作原料制取各物质的转化过程。
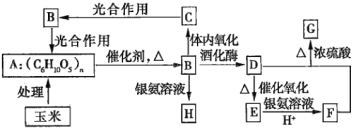
已知:
Ⅰ.G是具有果香气味的液体;D是重要的化工原料,并且可以代替汽油作汽车燃料。
Ⅱ.![]() 。
。
(1)A的名称为________,B的分子式为________,F的结构简式为________,G的结构简式为________。
(2)下列关于B的说法正确的是________(填序号)。
a.1molB能水解生成2molCH3CH2OH和2molCO2
b.欲检验A生成的B是否具有还原性,可向水解后的溶液中直接加入新制的Cu(OH)2悬浊液并加热
c.B不能发生酯化反应
d.蔗糖的水解产物之一为B
(3)由C→B的能量转化过程中,能量的转化形式为________能转化为________能。
(4)D→E的化学方程式为________________。
(5)写出足量的F与甘油、浓硫酸在加热条件下发生反应的化学方程式:________________,反应类型为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.2SO2(g)+O2(g)![]() 2SO3(g),反应过程的能量变化如图所示:
2SO3(g),反应过程的能量变化如图所示:
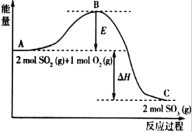
已知2mol SO2(g)和O2(g)反应生成为1mol SO3(g)的ΔΗ=-99kJ·mol-1,请回答下列问题。
(1)该反应通常用V2O5作催化剂,加V2O5会使图中B点_______ (填“升高”或“降低”)。
(2)图中ΔΗ= __________。
(3)如果反应速率v(SO2)为0.05mol·L-1·min-1,则v(O2)= _______。
Ⅱ.已知下列热化学方程式:
①H2O(l)===H2(g)+![]() O2(g)ΔH=+285.8 kJ/mol
O2(g)ΔH=+285.8 kJ/mol
②H2(g)+![]() O2(g)===H2O(g)ΔH=-241.8 kJ/mol
O2(g)===H2O(g)ΔH=-241.8 kJ/mol
③NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH=-57.3 kJ/mol
④C(s)+![]() O2(g)===CO(g) ΔH=-110.5 kJ/mol
O2(g)===CO(g) ΔH=-110.5 kJ/mol
⑤C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ/mol
回答下列问题:
(1)上述反应中属于吸热反应的是___________;
(2)燃烧10 g H2生成液态水,放出的热量为__________;
(3)写出CO燃烧的热化学方程式__________;
(4)写出制水煤气的热化学方程式_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为检验一批因露置而部分变质的Ba(OH)2药品的成分,某化学探究性学习小组设计了方案对其进行将20.45g药品分成五等分,逐渐加入100mL1 mol/L的盐酸中,并充分搅拌,测得生成气体的体积(已换算为标准状况下)、剩余固体的量与固体加入量的关系如图所示。考虑到某地附近为硫酸工业区,该小组同学判断此药品可能含三或四种成分。

(1) 写出硫酸工业尾气与过量的Ba(OH)2反应的离子方程式:________________________
(2)提出以下三种合理假设:(已知在空气中Ba(OH)2很难生成酸式盐)
假设一:药品成分为Ba(OH)2和BaSO4、BaSO3;
假设二:药品成分为Ba(OH)2和________________;
假设三:药品成分为Ba(OH)2和________________。
(3)实验验证:为确定该药品的成分,该小组利用上述实验中生成的气体,选择适当的试剂进行探究,请设计合理方案填入下表:
实验操作 | 预期实验现象和结论 |
| 若____________________,假设一成立; |
(4)问题讨论:若经试验验证,此药品为四种成分混合物,该小组同学认为由上述曲线可知,当所加固体质量为12.27 g时,药品成分与盐酸刚好完全反应,你认为该组同学的判断是否正确______。(填“是”或者“否”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定质量的甲烷燃烧后得到的产物为CO、CO2和水蒸气,此混合气体质量为49.6g,当其缓慢经过无水CaCl2时,CaCl2增重25.2g,原混合气体中CO2的质量为( )
A.12.5gB.13.2gC.19.7gD.24.4g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com