
【题目】一定条件下,纤维素与乙酸酐反应可以制取醋酸纤维,同时还有乙酸生成,请写出化学方程式__________________________ ,化学反应类型_________________。已知某纤维乙酸酯的平均相对分子质量为311040,则对应的纤维素分子中平均含有的葡萄糖结构单元数(即聚合度n)是___________。
科目:高中化学 来源: 题型:
【题目】新装修的房屋会释放出有毒的甲醛气体。银-Ferrozine法检测甲醛(HCHO)的原理如下(在原电池中完成氧化银与甲醛的反应)。下列说法正确的是
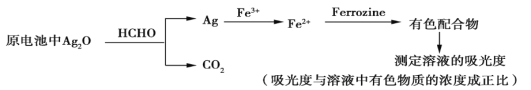
A. 其他条件相同,甲醛浓度越小,所得有色配合物溶液的吸光度越大
B. 电池正极的电极反应式为Ag2O+2H++2e-![]() 2Ag+H2O
2Ag+H2O
C. 30 g HCHO被氧化时,理论上电路中通过2 mol电子
D. 理论上,消耗HCHO和消耗Fe3+的物质的量之比为4∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应A(g) + B(g)=== 2C(g)在某段时间内以A的浓度变化表示的化学反应速率为0.5mol L—1 min—1,则此段时间内以C的浓度变化表示的化学反应速率为( )
A. 0.5mol L—1 min—1B. 1 mol L—1 min—1
C. 2 mol L—1 min—1D. 3 mol L—1 min—1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一未知的无色溶液,只可能含有以下离子中的若干种(忽略由水电离产生的H+、OH-):H+、NH4+、K+、Mg2+、Cu2+、Al3+、NO3-、CO32-、SO42-,现取三份100 mL溶液进行如下实验:
①第一份加足量AgNO3溶液后,有白色沉淀产生。②第二份加足量BaCl2溶液后,有白色沉淀产生,经洗涤、干燥后,沉淀质量为6.99 g。③第三份逐滴滴加NaOH溶液,测得沉淀与NaOH溶液的体积关系如图。根据上述实验,以下推测不正确的是
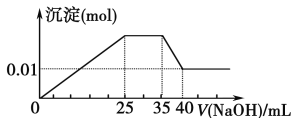
A. 原溶液一定不存在H+、Cu2+、CO32-
B. 不能确定原溶液是否含有K+、NO3-
C. 原溶液确定含Mg2+、Al3+、NH4+,且n(Mg2+)∶n(Al3+)∶n(NH4+)=1∶1∶2
D. 实验所加的NaOH的浓度为2 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在 a L Al2(SO4)3和(NH4)2SO4的混合溶液中加入b mol BaCl2,恰好使溶液中的SO42-完全沉淀;如加入足量强碱并加热可得到c mol NH3气体,则原溶液中的Al3+浓度(mol/L)为( )
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
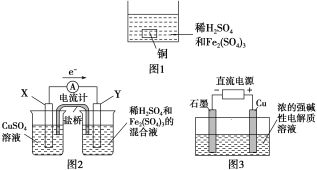
A. 如图1所示将一定量的铜片加入到100 mL稀硫酸和硫酸铁的混合溶液中,若铜片完全溶解时(不考虑盐的水解及溶液体积的变化),溶液中的Fe3+、Cu2+、H+三种离子的物质的量浓度相等,且测得溶液的pH=1,则溶液中c(SO![]() )为0.5 mol/L
)为0.5 mol/L
B. 如图2所示的装置中发生Cu+2Fe3+===Cu2++2Fe2+的反应,X极是负极,Y极的材料可以是铜
C. Cu2O是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解池示意图如图3所示,石墨电极上产生氢气,铜电极发生还原反应
D. 如图3所示当有0.1 mol电子转移时,有0.1 mol Cu2O生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)根据物质结构有关性质和特点,回答以下问题:
(1)过渡元素Co 基态原子价电子轨道表达式为_______________________________。第四电离能I4 (Co) < I4 (Fe) ,其原因是__________________________________________。
(2)磷的氯化物有两种:PCl3和PCl5 ,PCl3中磷原子的杂化类型为__________,PCl3的立体构型为__________,其中PCl3的沸点________(填“大于”或“小于”)PCl5,原因是__________。
(3)酞菁铟是有机分子酞菁与金属铟形成的复杂分子,结构简式如下图所示,该分子中存在的化学键为___________(填选项字母)
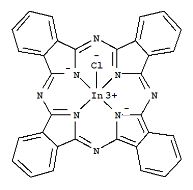
a.σ键 b.π键 c.离子键 d.配位键
(4)氯有多种含氧酸,其电离平衡常数如下:
化学式 | HClO4 | HClO3 | HClO2 | HClO |
Ka | 1×1010 | 1×10 | 1×102 | 4×108 |
从物质结构的角度解释以上含氧酸 Ka 依次减小的原因________________________。
(5)钴的一种化合物的晶胞结构如下图所示:
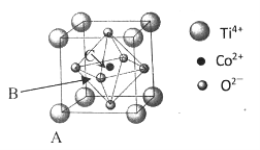
①已知A点的原子坐标参数为(0,0,0),C 点为(1/2,1/2,1/2),则B点的原子坐标参数为___________。
②已知晶胞参数 a = 0.5485 nm,则该晶体的密度为_______________g/cm3。(列出计算表达式即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在通常情况下,稀有气体很难与其他元素发生化学反应,其原因是
A.稀有气体最外层电子数均为8个,很稳定
B.稀有气体的电子层数比较多,很稳定
C.稀有气体的最外层电子数均达到稳定结构
D.稀有气体的原子核所带电荷较多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在鯨体内,基本的化学元素和干重状态下含量最多的有机物分别是( )
A. C.P.N .K和蛋白质 B. C和水 C. C.H .O.N.和蛋白质 D. O和蛋白质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com