
【题目】工业上制得的是熔融态的镁,可以在( )中冷却
A.空气B.氮气C.CO2D.H2
科目:高中化学 来源: 题型:
【题目】某研究性学习小组对过量炭粉与氧化铁反应的气体产物成分进行研究。
(1)提出假设 ①该反应的气体产物是CO2。 ②该反应的气体产物是CO。③该反应的气体产物是______________。
(2)设计方案 如图所示,将一定量的氧化铁在隔绝空气的条件下与过量炭粉完全反应,测定参加反应的碳元素与氧元素的质量比。
(3)查阅资料
氮气不与碳、氧化铁发生反应。实验室可以用氯化铵饱和溶液和亚硝酸钠(NaNO2)饱和溶液混合加热反应制得氮气。请写出该反应的离子方程式:_________________________________。
(4)实验步骤

①按上图连接装置,并检查装置的气密性,称取3.20g氧化铁、2.00g碳粉混均匀,放入48.48g的硬质玻璃管中;
②加热前,先通一段时间纯净干燥的氮气;
③停止通入N2后,夹紧弹簧夹,加热一段时间,澄清石灰水(足量)变浑浊;
④待反应结束,再缓缓通入一段时间的氮气。冷却至室温,称得硬质玻璃管和固体总质量为52.24g;
⑤过滤出石灰水中的沉淀,洗涤、烘干后称得质量为2.00g。
步骤②、④中都分别通入N2,其作用分别为_________________________________。
(5)数据处理
试根据实验数据分析,写出该实验中氧化铁与碳发生反应的化学方程式:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z 是短周期元素,在周期表中的位置关系如图所示,下列说法不正确的是( )
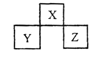
A. Z单质的熔点一定高于Y单质
B. X最简单的气态氢化物的稳定性一定高于Y的气态氢化物
C. X、Z的原子序数之和与Y 的原子序数之比可能为5:3
D. 若Z的最高价氧化物为Z2O7,则Y的气态氢化物为YH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在105℃、1个大气压时,取两种气态烃1L与9L氧气混合,充分燃烧后恢复到原状态,所得气体体积仍是10L。有下列组合的混合烃:①C2H4和C3H4 ②CH4和C2H6 ③CH4和C3H4 ④C2H2和C3H6,其中可能符合上述要求的是
A. 只有①②B. 只有①③④C. 只有①③D. 只有②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH=1的某溶液X中仅含有NH4+、Al3+、Ba2+、Fe2+、Fe3+、CO32﹣、SO32﹣、SO42﹣、Cl﹣、NO3﹣中的一种或几种(忽略水的电离及离子的水解),取该溶液进行连续实验,实验过程如图:下列有关推断不正确的是( )
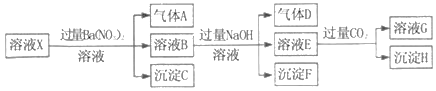
A. 溶液X中一定含有H+、Al3+、NH4+、Fe2+、SO42﹣
B. 根据上述连续实验不能确定溶液X中是否含有Fe3+、Cl﹣
C. 沉淀H为Al(OH)3、BaCO3的混合物
D. 若溶液X为100mL,产生的气体A为44.8mL(标准状况),则X中c(Fe2+)=0.06molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制备硫酸最重要的一步是SO2的氧化。反应方程式如下: 2SO2(g)+O2(g)![]() 2SO3(g) △H=-196kJ/mol
2SO3(g) △H=-196kJ/mol
回答下列问题:
(1)该反应在________下能自发进行(选填“较高温度”“较低温度”)。
(2)某课外兴趣小组在实验室对该反应进行研究,部分数据如下表。
实验 | 反应条件 | 起始物质的量 | 平衡后性质 | ||||||
催化剂 | 温度(K) | 容积(L) | SO2 | O2 | SO3 | SO2体积分数 | 吸收或放出热量(KJ) | SO2或SO3转化率 | |
① | V2O5 | 770 | 10 | 0.2 | 0.1 | 0 | a1 | Q1 | α1 |
② | V2O5 | 770 | 10 | 0 | 0 | 0.2 | a2 | Q2 | α2 |
③ | V2O5 | 绝热 | 10 | 0 | 0 | 0.2 | a3 | Q3 | α3 |
比较下列数值大小(选填“>”“=”“<”“无法确定”)。
①a1________a2
②Q1+Q2________19.6
③α1+α3 ______ 1
(3) 某同学通过实验绘出如下图像。

t1、t2、t3达到化学平衡状态的是____________
(4)若α1=0.9,计算770K时,正反应的平衡常数为___________。
(5)工业上将SO2转化为SO3时。为了提高反应速率,并有利于SO3的吸收,需要对原料混合气体预热,同时对SO3气体降温。通常采用如图所示的热交换器(中间为空心管道)。下列说法正确的是____________

a.使用热交换器可以充分利用能源
b.A、B、C三处气体的组成相同
c.A、B、C、D四处的气体中均含有SO2
d.预热原料混合气主要是为了提高SO2的平衡转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一种锂电池,用金属锂和石墨作电极材料,电解质溶液是由四氯铝锂(LiAlCl4)溶解在亚硫酰氯(![]() )中而形成的,电池总反应方程式为:8Li+3SOCl2===6LiCl+Li2SO3+2S,下列叙述中正确的是( )
)中而形成的,电池总反应方程式为:8Li+3SOCl2===6LiCl+Li2SO3+2S,下列叙述中正确的是( )
A. 电解质溶液中混入水,对电池反应无影响
B. 金属锂作电池的正极,石墨作电池的负极
C. 电池工作过程中,亚硫酰氯(SOCl2)被还原为Li2SO3
D. 电池工作过程中,金属锂提供的电子与正极区析出的硫的物质的量之比为4∶1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com