
【题目】工业上制备硫酸最重要的一步是SO2的氧化。反应方程式如下: 2SO2(g)+O2(g)![]() 2SO3(g) △H=-196kJ/mol
2SO3(g) △H=-196kJ/mol
回答下列问题:
(1)该反应在________下能自发进行(选填“较高温度”“较低温度”)。
(2)某课外兴趣小组在实验室对该反应进行研究,部分数据如下表。
实验 | 反应条件 | 起始物质的量 | 平衡后性质 | ||||||
催化剂 | 温度(K) | 容积(L) | SO2 | O2 | SO3 | SO2体积分数 | 吸收或放出热量(KJ) | SO2或SO3转化率 | |
① | V2O5 | 770 | 10 | 0.2 | 0.1 | 0 | a1 | Q1 | α1 |
② | V2O5 | 770 | 10 | 0 | 0 | 0.2 | a2 | Q2 | α2 |
③ | V2O5 | 绝热 | 10 | 0 | 0 | 0.2 | a3 | Q3 | α3 |
比较下列数值大小(选填“>”“=”“<”“无法确定”)。
①a1________a2
②Q1+Q2________19.6
③α1+α3 ______ 1
(3) 某同学通过实验绘出如下图像。

t1、t2、t3达到化学平衡状态的是____________
(4)若α1=0.9,计算770K时,正反应的平衡常数为___________。
(5)工业上将SO2转化为SO3时。为了提高反应速率,并有利于SO3的吸收,需要对原料混合气体预热,同时对SO3气体降温。通常采用如图所示的热交换器(中间为空心管道)。下列说法正确的是____________

a.使用热交换器可以充分利用能源
b.A、B、C三处气体的组成相同
c.A、B、C、D四处的气体中均含有SO2
d.预热原料混合气主要是为了提高SO2的平衡转化率
【答案】较低温度 = = < t2 8.1×104 abc
【解析】
(1)根据△H<0,△S<0,△G=△H-T△S来分析。
(2)①0.2molSO2和0.1molO2,从正方向开始反应建立的平衡与0.2molSO3从逆方向开始反应建立的平衡为等效平衡。
②结合①中的分析可知实验①和实验②为等效平衡,可推知a1+ a2=1。
③在绝热的实验条件下,由于该反应逆方向为吸热反应,温度较低,平衡正向移动。
(3)SO2和O2的化学计量比为2:1,当SO2的消耗速率是O2的生成速率的2倍时表示该反应达到化学平衡。
(4)根据三段式解答。
(5)a. 使用热交换器可以使反应充分进行,提高原料的利用率。
b.原料SO2、O2从装置左侧A处进入热交换器,吸收热量后由B处流出再从C口进入催化反应室发生反应,并放出大量的热,,最终反应的气体从D口排出,故A、B、C三处的气体组成为SO2、O2。
c.结合b项分析知A、B、C三处气体中含有SO2,由于该反应为可逆反应,可推知D处气体中也含有SO2。
d.正反应为放热反应,温度升高,平衡逆向移动,SO2的平衡转化率降低。
(1)△H<0,△S<0,△G=△H-T△S,在较低温度下△G小于零,说明该反应在较低温度下能自发进行,故答案为:较低温度。
(2)①0.2molSO2和0.1molO2,从正方向开始反应建立的平衡与0.2molSO3从逆方向开始反应建立的平衡为等效平衡,所以达到平衡后各物质的物质的量均相同,即达到平衡后两组实验中的SO2的体积分数相同,故a1=a2,故答案为:=。
②结合①中的分析可知实验①和实验②为等效平衡,可推知a1+ a2=1,实验①中可计算出Q1=(0.2mol×196 kJ/mol×a1)/2=19.6 a1 KJ,实验②中可计算出Q2=(0.2mol×196 kJ/mol×a2)/2=19.6 a2 KJ,则Q1+ Q2=19.6 a1+19.6 a2=19.6(a1+ a2)=19.6,故答案为:=。
③在绝热的实验条件下,由于该反应逆方向为吸热反应,温度较低,平衡正向移动,SO3的物质的量增加,则SO3的转化率降低,可推知α3< a2,结合②中的分析知α1+α3 <1,故答案为:<。
(3)SO2和O2的化学计量比为2:1,当SO2的消耗速率是O2的生成速率的2倍时表示该反应达到化学平衡,观察图像可知,t2时刻SO2的消耗速率是O2的生成速率的2倍,达到化学平衡状态,故答案为:t2。
(4)由题可知转化的SO2的物质的量为:0.2mol×0.9=0.18mol,
2SO2(g)+O2(g)![]() 2SO3(g)
2SO3(g)
起始浓度(mol/L) 0.2 0.1 0
转化浓度(mol/L) 0.18 0.09 0.18
平衡浓度(mol/L) 0.02 0.01 0.18
平衡常数K=( 0.18 /10)2/ (0.02 /10)2×(0.01 /10)= 8.1×104 ,故答案为:8.1×104 。
(5)a. 使用热交换器可以使反应充分进行,提高原料的利用率,故a正确;
b.原料SO2、O2从装置左侧A处进入热交换器,吸收热量后由B处流出再从C口进入催化反应室发生反应,并放出大量的热,,最终反应的气体从D口排出,故A、B、C三处的气体组成为SO2、O2,故b正确;
c.结合b项分析知A、B、C三处气体中含有SO2,由于该反应为可逆反应,可推知D处气体中也含有SO2,故c正确;
d.正反应为放热反应,温度升高,平衡逆向移动,SO2的平衡转化率降低,故d错误。
故答案为:abc。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】如图所示,甲、乙、丙是三种常见单质,X、Y、Z是常见化合物,它们之间有如下转化关系:
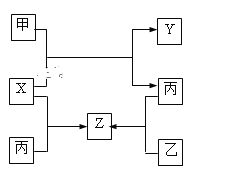
⑴若甲是短周期金属单质,乙、丙是短周期非金属单质,X、Y、Z中只有一种是离子晶体, 试推断:
①X的电子式是______________________________。
②X与甲反应的化学方程式______________________________________________。
⑵若甲是气体单质,丙通常是液体,Y和Z具有相同的阳离子,X与Z含有相同的阴离子,试推断:
①写出Z的化学式_______________________。
②写出X与足量的甲在溶液中完全反应的离子方程式:_________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2SO2(g)+O2(g) ![]() 2SO3(g)△H =-198kJ·mol-1。400℃,1.01×105Pa,向容积为2L 的恒容密闭容器中充入一定量SO2和O2,n(SO3)和n(O2)等随时间的变化曲线如图所示。下列叙述正确的是
2SO3(g)△H =-198kJ·mol-1。400℃,1.01×105Pa,向容积为2L 的恒容密闭容器中充入一定量SO2和O2,n(SO3)和n(O2)等随时间的变化曲线如图所示。下列叙述正确的是

A. A点v 正(SO2) >v 逆(SO3) B. B点表示反应处于平衡状态
C. D点n(SO2)大于C点 D. 其它条件不变,升温至500℃并达平衡时,n(SO3)比图中D 点的值大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮和碳的化合物与人类生产、生活密切相关。
(1)已知:N2(g)+O2(g)===2NO(g); ΔH=+180.5 kJ·mol-1
2H2(g)+O2(g)===2H2O(g); ΔH=-483.6 kJ·mol-1
则反应2H2(g)+2NO(g)===2H2O(g)+N2(g);ΔH=__________。
(2)在压强为0.1 MPa条件,将CO和H2的混合气体在催化剂作用下转化为甲醇的反应为CO(g)+2H2(g) ![]() CH3OH(g) ΔH<0
CH3OH(g) ΔH<0
①下列能说明该反应达到平衡状态的是________________。
a.混合气体的密度不再变化 b.CO和H2的物质的量之比不再变化
c.v(CO)=v(CH3OH) d.CO在混合气中的质量分数保持不变
②T1℃时,在一个体积为5 L的恒压容器中充入1 mol CO、2 mol H2,经过5 min达到平衡,CO的转化率为0.75,则T1℃时,CO(g)+2H2(g) ![]() CH3OH(g)的平衡常数K=_______________________。
CH3OH(g)的平衡常数K=_______________________。

③在T1℃时,在体积为5 L的恒容容器中充入一定量的H2和CO,反应达到平衡时CH3OH的体积分数与n(H2)/n(CO)的关系如图所示。温度不变,当![]() 时,达到平衡状态,CH3OH的体积分数可能是图象中的___________点。
时,达到平衡状态,CH3OH的体积分数可能是图象中的___________点。
(3)用催化转化装置净化汽车尾气,装置中涉及的反应之一为:2NO(g)+2CO(g)![]() N2(g)+2CO2(g)
N2(g)+2CO2(g)

①探究上述反应中NO的平衡转化率与压强、温度的关系,得到如图1所示的曲线。催化装置比较适合的温度和压强是___________。
②测试某型号汽车在冷启动(冷启动指发动机水温低的情况下启动)时催化装置内CO和NO百分含量随时间变化曲线如图2所示。则前10 s内,CO和NO百分含量没明显变化的原因是____________。

(4)如图所示的装置能吸收和转化NO2和SO2。
①阳极区的电极反应式为___________________________。
②阴极排出的溶液中含S2O![]() 离子,能将NO2气体转化为无污染气体,同时生成的SO
离子,能将NO2气体转化为无污染气体,同时生成的SO![]() 可在阴极区再生。写出该反应的离子方程式:___________________________。
可在阴极区再生。写出该反应的离子方程式:___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家通过测量SiO2中26 Al和10 Be两种元素的比例来确定“北京人”的年龄,这种测量方法叫铝铍测年法。下列关于26 Al和10 Be的说法不正确的是( )
A. 10 Be和9 Be是中子数不同、质子数相同的不同原子
B. 10 Be原子核内的中子数比质子数多
C. 5.2g 26 A13+中所含的电子数约为1.2![]() 1023
1023
D. 26AI和26 Mg的质子数、中子数和核外电子数都不相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2SO2(g)+O2 (g)![]() 2SO3(g);△H=﹣197kJmol﹣1.向同温、同体积的三个密闭容器中分别充入气体:(甲) 2mol SO2和1mol O2;(乙) 1mol SO2和0.5mol O2;(丙) 2mol SO3.恒温、恒容下反应达平衡时,下列关系一定正确的是( )
2SO3(g);△H=﹣197kJmol﹣1.向同温、同体积的三个密闭容器中分别充入气体:(甲) 2mol SO2和1mol O2;(乙) 1mol SO2和0.5mol O2;(丙) 2mol SO3.恒温、恒容下反应达平衡时,下列关系一定正确的是( )
A. 容器内压强p p甲=p丙>2p乙
B. SO3的质量m m甲=m丙<2m乙
C. c(SO2)与c(O2)之比k k甲=k丙>2k乙
D. 反应放出或吸收热量的数值Q Q甲=197﹣Q丙>2Q乙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在T℃时,发生反应Fe2O3 (s)+3CO(g) ![]() 2Fe(s) +3CO2 (g),该反应的平衡常数K= 64,在1L恒容密闭容器甲和乙中,甲中加有四种物质各1 mol,乙中加有Fe2O3 、Fe、CO2各1 mol, CO 2 mol。达平衡后,两容器中不相等的是( )
2Fe(s) +3CO2 (g),该反应的平衡常数K= 64,在1L恒容密闭容器甲和乙中,甲中加有四种物质各1 mol,乙中加有Fe2O3 、Fe、CO2各1 mol, CO 2 mol。达平衡后,两容器中不相等的是( )
A. 用CO表示的反应速率 B. 平衡混合气体的平均相对分子质量
C. CO的转化率 D. CO2的体积分数
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com