
【题目】滴定操作中眼睛注视______________。
科目:高中化学 来源: 题型:
【题目】依据氧化还原反应:Zn(s)+Cu2+(aq)===Zn2+(aq)+Cu(s)设计的原电池如下图所示。
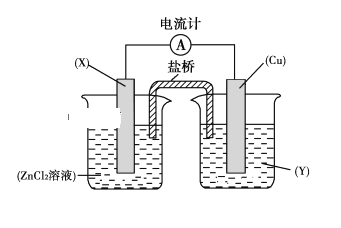
请回答下列问题:
(1)电极X的材料是________;电解质溶液Y是________。
(2)铜电极为电池的________极,发生的电极反应为______________________,X极上发生的电极反应为________________。
(3)外电路中的电子是从________极流向________极。
(4)盐桥中的Cl-向________极移动,如将盐桥撤掉,电流计的指针将________偏转。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,甲、乙、丙是三种常见单质,X、Y、Z是常见化合物,它们之间有如下转化关系:
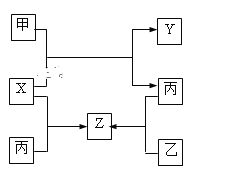
⑴若甲是短周期金属单质,乙、丙是短周期非金属单质,X、Y、Z中只有一种是离子晶体, 试推断:
①X的电子式是______________________________。
②X与甲反应的化学方程式______________________________________________。
⑵若甲是气体单质,丙通常是液体,Y和Z具有相同的阳离子,X与Z含有相同的阴离子,试推断:
①写出Z的化学式_______________________。
②写出X与足量的甲在溶液中完全反应的离子方程式:_________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将5 mL 0.005 mol/L FeCl3溶液和5 mL 0.015 mol/L KSCN溶液混合,达到平衡后呈红色。再将混合液分为5份,分别进行如下实验:
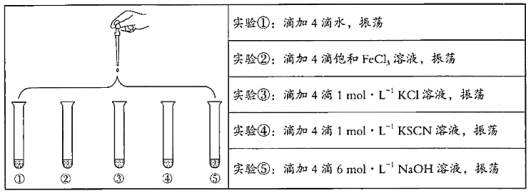
下列说法不正确的是
A. 对比实验①和②,为了证明增加反应物浓度,平衡发生正向移动
B. 对比实验①和③,为了证明增加反应物浓度,平衡发生逆向移动
C. 对比实验①和④,为了证明增加反应物浓度,平衡发生正向移动
D. 对比实验①和⑤,为了证明减少反应物浓度,平衡发生逆向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.(1)反应I2+2S2O32-===2I-+S4O62-常用于精盐中碘含量测定。某同学利用该反应探究浓度对反应速率的影响。实验时均加入1 mL淀粉溶液作指示剂,若不经计算,直接通过褪色时间的长短判断浓度与反应速率的关系,下列试剂中应选择____(填序号)。
①1 mL 0.01 mol·L-1的碘水 ②1mL0.001 mol·L-1的碘水
③4 mL 0.01 mol·L-1的Na2S2O3溶液 ④4mL0.001 mol·L-1的Na2S2O3溶液
(2)若某同学选取①③进行实验,测得褪色时间为4s,计算v(S2O32-)=_____。
Ⅱ.一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生反应NO2(g)+SO2(g)![]() SO3(g)+NO(g),下列能说明反应达到平衡状态的是___。
SO3(g)+NO(g),下列能说明反应达到平衡状态的是___。
a.体系压强保持不变 b.混合气体颜色保持不变
c.SO3和NO2的物质的量之比保持不变 d.每消耗1 mol SO3的同时生成1 molNO2
Ⅲ.已知2NO2(g)![]() N2O4(g) ΔH<0。现将NO2和N2O4的混合气体通入恒温恒容为2升的密闭容器中,反应体系中物质浓度随时间的变化关系如图所示。
N2O4(g) ΔH<0。现将NO2和N2O4的混合气体通入恒温恒容为2升的密闭容器中,反应体系中物质浓度随时间的变化关系如图所示。
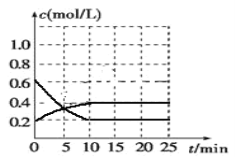
①平衡时NO2的转化率____;②起始压强与平衡时压强之比____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业生产以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为:
2NH3(g)+CO2(g)![]() CO(NH2)2(l)+H2O(l)
CO(NH2)2(l)+H2O(l)
(1)在密闭容器中充入NH3和CO2 ,一定条件能自发进行的原因是__________________;
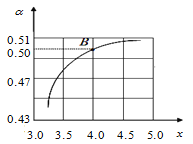
(2)T1℃时,在2 L的密闭容器中充入NH3和CO2模拟工业生产,若原料气中的NH3和CO2的物质的量之比(氨碳比)![]() =x,如图是CO2平衡转化率(α)与氨碳比(x)的关系。其它条件不变时,α随着x增大而增大的原因是_________________;
=x,如图是CO2平衡转化率(α)与氨碳比(x)的关系。其它条件不变时,α随着x增大而增大的原因是_________________;
(3)当x=2,上述反应至5min时各物质的浓不再发生变化,若起始的压强为P0 KPa,测得平衡体系压强变为起始时的![]() 。反应结束后,分离得到90g尿素。
。反应结束后,分离得到90g尿素。
试计算该反应的平均速率v(CO2)=___________________,
该反应的平衡常数(K)=________________,
达到平衡后NH3的物质的量浓度为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2SO2(g)+O2(g) ![]() 2SO3(g)△H =-198kJ·mol-1。400℃,1.01×105Pa,向容积为2L 的恒容密闭容器中充入一定量SO2和O2,n(SO3)和n(O2)等随时间的变化曲线如图所示。下列叙述正确的是
2SO3(g)△H =-198kJ·mol-1。400℃,1.01×105Pa,向容积为2L 的恒容密闭容器中充入一定量SO2和O2,n(SO3)和n(O2)等随时间的变化曲线如图所示。下列叙述正确的是

A. A点v 正(SO2) >v 逆(SO3) B. B点表示反应处于平衡状态
C. D点n(SO2)大于C点 D. 其它条件不变,升温至500℃并达平衡时,n(SO3)比图中D 点的值大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在T℃时,发生反应Fe2O3 (s)+3CO(g) ![]() 2Fe(s) +3CO2 (g),该反应的平衡常数K= 64,在1L恒容密闭容器甲和乙中,甲中加有四种物质各1 mol,乙中加有Fe2O3 、Fe、CO2各1 mol, CO 2 mol。达平衡后,两容器中不相等的是( )
2Fe(s) +3CO2 (g),该反应的平衡常数K= 64,在1L恒容密闭容器甲和乙中,甲中加有四种物质各1 mol,乙中加有Fe2O3 、Fe、CO2各1 mol, CO 2 mol。达平衡后,两容器中不相等的是( )
A. 用CO表示的反应速率 B. 平衡混合气体的平均相对分子质量
C. CO的转化率 D. CO2的体积分数
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com