
等物质的量浓度、等体积的下列溶液中:
①H2CO3、②Na2CO3、③NaHCO3、④NH4HCO3、⑤(NH4)2CO3,下列关系或者说法正确的是( )
| A.c(CO32—)的大小关系为:②>⑤>③>④>① |
| B.c(HCO3—)的大小关系为:④>③>⑤>②>① |
| C.将溶液蒸干灼烧后只有①不能得到对应的固体物质 |
| D.②③④⑤既能与盐酸反应,又能与NaOH溶液反应 |
科目:高中化学 来源: 题型:单选题
实验:① 将0.1 mol·L-1 MgCl2溶液和0.5 mol·L-1NaOH溶液等体积混合得到浊液;
② 取少量①中浊液,滴加0.1 mol·L-1FeCl3溶液,出现红褐色沉淀;
③ 将①中浊液过滤,取少量白色沉淀,滴加0.1 mol·L-1FeCl3溶液,白色沉淀变为红褐色;
④ 另取少量白色沉淀,滴加饱和NH4Cl溶液,沉淀溶解。
下列说法中,不正确的是:
| A.将①中所得浊液过滤,所得滤液中含少量Mg2+ |
B.浊液中存在溶解平衡:Mg(OH)2(s)  Mg2+(aq) + 2OH-(aq) Mg2+(aq) + 2OH-(aq) |
| C.实验②和③均能说明Fe(OH)3比Mg(OH)2难溶 |
| D.NH4Cl溶液中的NH4+可能是④中沉淀溶解的原因 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
25℃时,由弱酸(HA)及其盐(NaA)组成的混合溶液,起始浓度均为1mol·L-1。下图为向该溶液中通入HCl气体或加入NaOH固体时,溶液pH随加入H+或OH-的物质的量而变化的曲线。下列说法中,不正确的是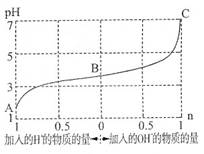
A.A、B、C三点所表示的溶液中水的电离程度依次增大
B.通入HCl,HA的电离常数减小,A-的水解程度增大
C.加入1 mol NaOH后,溶液中c(Na+)=c(A-)
D.未加HCl和NaOH时,溶液中c(A-)>c(Na+)>c(HA)
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
能说明醋酸是弱电解质的是
| A.中和10mL 1mol/L CH3COOH溶液需要10ml 1mol/L NaOH溶液 |
| B.用食醋可以除热水瓶内的水垢 |
| C.pH=2的醋酸溶液稀释1000倍后pH小于5 |
| D.用浓H2SO4和醋酸钠固体共热可制得醋酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
某温度下,体积和pH都相同的盐酸和氯化铵溶液加水稀释时的pH变化曲线如图所示,下列判断正确的是
| A.a、c两点溶液的导电能力相同 |
| B.b点溶液中c(H+)+c(NH3·H2O)=c(OH-) |
| C.a、b、c三点溶液中水的电离程度a>b>c |
| D.用等浓度NaOH溶液和等体积b、c处溶液反应,消耗NaOH溶液体积Vb=Vc |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
甲酸的下列性质中,可以证明它是弱电解质的是( )
| A.1 mol/L甲酸溶液的c(H+)=0.01 mol/L |
| B.甲酸能与水以任何比例互溶 |
| C.10 mL 1 mol/L甲酸恰好与10 mL 1 mol/L NaOH溶液完全反应 |
| D.甲酸溶液的导电性比盐酸的弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知AgI为黄色沉淀,AgCl为白色沉淀。25°C时,AgI饱和溶液中c(Ag+)为1.22×10-8mol·L-1,AgCl饱和溶液中c(Ag+)为1.30×10-5mol·L-1。若在5 mL含有KCl和KI浓度均为0.01 mol·L-1的混合溶液中,滴加8 mL 0.01mol·L-1的AgNO3溶液,则下列叙述中不正确的是 ( )
| A.溶液中所含溶质的离子浓度大小关系为:c(K+)>c(NO3—)>c(Cl-)>c(I-)>c(Ag+) |
| B.溶液中先产生的是AgI沉淀 |
| C.AgCl的Ksp的数值为1.69×10-10 |
| D.若在AgI悬浊液中滴加少量的KCl溶液,黄色沉淀不会转变成白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
向含有H2SO4的CuSO4溶液中逐滴加入含a mol溶质的NaOH溶液,恰好使溶液的pH=7,下列叙述错误的是 ( )
| A.反应后溶液中c(Na+)=2c(SO42—) |
| B.a/2mol>沉淀的物质的量>0 |
| C.沉淀的质量=49a g |
| D.溶液中n(SO42—)=a/2 mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com