
| A、柠檬酸分子 |
| B、柠檬酸根 |
| C、H+ |
| D、OH- |
 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:

| 沉淀物 | Fe(OH)3 | Al(OH)3 | Zn(OH)2 |
| 开始沉淀pH | 2.3 | 4.0 | 5.4 |
| 完全沉淀pH | 4.1 | 5.2 | 8.0 |

查看答案和解析>>
科目:高中化学 来源: 题型:
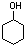 )是一种有机化工基础原料,工业上的主要合成途径及有关反应如下:
)是一种有机化工基础原料,工业上的主要合成途径及有关反应如下:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=0的溶液中:Ca2+、Al3+、ClO-、Cl- |
| B、含有大量AlO2-的溶液中:K+、Ca2+、Br-、HCO3- |
| C、加入Mg能放出H2的溶液中:Na+、NH4+、Cl-、SO42- |
| D、酚酞显无色的溶液中:K+、Fe3+、NO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
 一种将CO2变为燃料或有机化学品的构想分成3个步骤:
一种将CO2变为燃料或有机化学品的构想分成3个步骤:| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①④⑤ | B、①②③④ |
| C、①③④⑤ | D、全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、32g臭氧中,含有氧原子2NA |
| B、在标准状况下,2.24L苯中所含分子数约为NA |
| C、9g D2O中含有的电子数为5NA |
| D、7.1g氯气与足量氢氧化钠溶液反应转移的电子数为0.2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com