
分析 (1)根据反应物与生成物来书写反应方程式;
(2)根据反应物与生成物来书写反应方程式;
(3)根据KMnO4能与热的经硫酸化的Na2C2O4反应生成Mn2+和CO2,并利用质量守恒定律来书写反应方程式;
(4)利用(3)中的化学反应方程式及恰好与0.335g纯Na2C2O4反应完全来计算.
解答 解:(1)由软锰矿与过量固体KOH和KClO3在高温下反应,生成锰酸钾(K2MnO4)和KCl,则反应为3MnO2+6KOH+KClO3$\frac{\underline{\;\;△\;\;}}{\;}$3K2MnO4+KCl+3H2O,
故答案为:3MnO2+6KOH+KClO3$\frac{\underline{\;\;△\;\;}}{\;}$3K2MnO4+KCl+3H2O;
(2)由滤液酸化后,K2MnO4转变为MnO2和KMnO4,则反应为3MnO42-+4H+═MnO2↓+2MnO4-+2H2O,
故答案为:3MnO42-+4H+═MnO2↓+2MnO4-+2H2O;
(3)由KMnO4能与热的经硫酸化的Na2C2O4反应生成Mn2+和CO2,则反应为2KMnO4+5Na2C2O4+8H2SO4 $\frac{\underline{\;\;△\;\;}}{\;}$K2SO4+2MnSO4+5Na2SO4+10CO2↑+8H2O,
故答案为:2KMnO4+5Na2C2O4+8H2SO4 $\frac{\underline{\;\;△\;\;}}{\;}$K2SO4+2MnSO4+5Na2SO4+10CO2↑+8H2O;
(4)设该KMnO4的纯度为y,根据2KMnO4+5Na2C2O4+8H2SO4 $\frac{\underline{\;\;△\;\;}}{\;}$K2SO4+2MnSO4+5Na2SO4+10CO2↑+8H2O可知,
$\frac{2}{5}$KMnO4---Na2C2O4
$\frac{2}{5}$×158 134
0.165×y 0.335
y=$\frac{\frac{0.335g}{134g/mol}×\frac{2}{5}×158g/mol}{0.165g}$×100%=95.8%,
答:该KMnO4的纯度为95.8%.
点评 本题考查化学反应方程式的书写及有关氧化还原反应的计算,明确反应物与生成物及物质之间的关系是解答的关键,难度不大.


 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:解答题
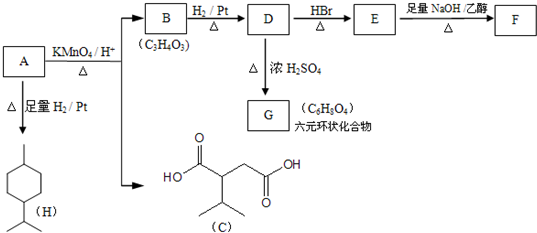
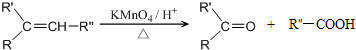
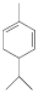 .
.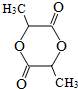 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
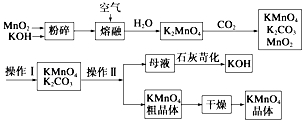 高锰酸钾可用于生活消毒,是中学化学常见的氧化剂.工业上,用软锰矿制高锰酸钾的流程如下:
高锰酸钾可用于生活消毒,是中学化学常见的氧化剂.工业上,用软锰矿制高锰酸钾的流程如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 烷烃名称 | 乙烷 | 丙烷 | 丁烷 | 戊烷 |
| 沸点(℃) | -88.6 | -42.1 | -0.5 | 36.1 |
| *燃烧热(kJ•mol-1) | 1560.7 | 2219.2 | 2877.6 | 3535.6 |
| A. | 正庚烷在常温常压下肯定不是气体 | |
| B. | 直链烷烃燃烧热和其所含碳原子数呈线性关系 | |
| C. | 随碳原子数增加,直链烷烃沸点逐渐升高 | |
| D. | 随碳原子数增加,直链烷烃沸点和燃烧热都成比例增加 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水电离产生的H+浓度为1×10-12mol•L-1的溶液:NH4+、Na+、Cl-、HCO3- | |
| B. | 能使pH试纸变深蓝色的溶液:Na+、AlO2-、S2-、CO32- | |
| C. | 含有大量Fe3+的溶液:SCN-、I-、K+、Br- | |
| D. | pH=1的水溶液中:Al3+、NH4+、CH3COO-、Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5mL | B. | 20mL | C. | 大于5mL | D. | 小于5mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀释溶液,水解平衡常数增大 | |
| B. | 升高温度,C(CO32-) 减小 | |
| C. | 稀释溶液,溶液中所有离子浓度均减小 | |
| D. | 加入NaOH(s),溶液pH减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
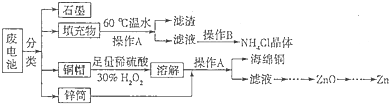
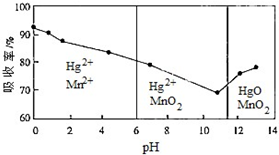
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
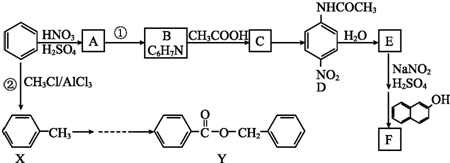
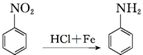
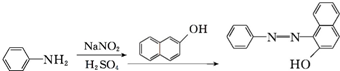
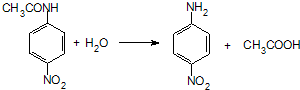 .
.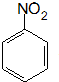 、F
、F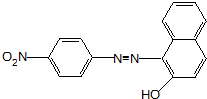 .
.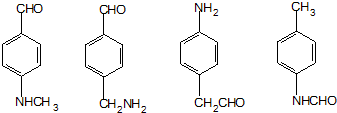 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com