
����Ŀ������������أ�K2FeO4����һ�����͡���Ч�������ɫˮ����������Cl2��O2��ClO2��KMnO4�����Ը�ǿ��������Ⱦ����ҵ�������Ƶø������ƣ�Ȼ���ڵ����£������������Һ�м���KOH�����ͣ�ʹ�������������
��1���ɷ��Ʊ��������Ƶ���Ҫ��ӦΪ��2FeSO4 + 6 Na2O2 = 2Na2FeO4 + 2Na2O + 2Na2SO4 + O2�����÷�Ӧ����������________���ѧʽ�����������ƣ�Na2O2������Ԫ�ػ��ϼ�Ϊ_____���������֣�
��2��ʪ���Ʊ�������أ�K2FeO4���ķ�Ӧ��ϵ��������������Fe��OH��3��ClO����OH����FeO42-��Cl����H2O��
�����������£��������ͻ�ԭ�������ʵ����ı�Ϊ3:2������Ӧ��д������ƽʪ���Ƹ�����ص����ӷ�Ӧ����ʽ��_________________��
��ÿ����1mol FeO42-ת��___mol���ӣ�����Ӧ������ת����0.3mol���ӣ���ԭ��������ʵ���Ϊ_____mol��
��3����ƽ���滯ѧ����ʽ���ش��������⣺____C +K2Cr2O7+H2SO4=K2SO4+CO2��+Cr2(SO4)3+H2O��
��H2SO4��������Ӧ�б��ֳ����������ǣ���ѡ���ţ�______��
A�������� B�������Ժ����� C������ D����ԭ�Ժ�����
������Ӧ�е���ת����0��8 mol��������������ڱ�״���µ����Ϊ_____L��
���𰸡�Na2O2 -1 4OH- + 2Fe(OH)3 + 3ClO- = 2FeO42- +3Cl- +5H2O 3 0.15 3 2 8 2 3 2 8 C 4.48
��������
��1��FeԪ�ػ��ϼ����ߣ�Na2O2��OԪ�صĻ��ϼ����ߡ�Ҳ���ͣ�
��2�����������£��������ͻ�ԭ�������ʵ����ı�Ϊ3��2������Ӧ����Fe (OH)3��ClO-�����ʵ�����Ϊ2��3�����ӷ�Ӧ��ѭ���ӡ���ɼ�ԭ���غ㣻��3����Ӧ��C��0�����ߵ�������̼�е�+4�ۣ�K2Cr2O7�е�Cr��+6�۽�ΪCr2(SO4)3�е�+3�ۣ�����������ԭ��Ӧ��ʧ�����غ���ɽ��ԭ�Ӹ����غ������ƽ����ʽ�������������ڷ�Ӧ��Ԫ�ػ��ϼ۱仯����ж�������ֵ����ʣ������ݷ���ʽ3C+2K2Cr2O7+8H2SO4=2K2SO4+3CO2��+2Cr2(SO4)3+8H2O��ÿ����3mol������̼��ת�Ƶ�����Ϊ3mol����4-0��=12mol���������ɶ�����̼�����ʵ���������V=nVm�������������
��1��FeԪ�ػ��ϼ����ߣ�Na2O2��OԪ�صĻ��ϼ����ߡ�Ҳ���ͣ���÷�Ӧ��Na2O2 ����������Na2O2����Ԫ��Ϊ-1�ۣ��ʴ�Ϊ��Na2O2��-1��
��2���ټ��������£��������ͻ�ԭ�������ʵ����ı�Ϊ3��2������Ӧ����Fe��OH��3��ClO-�����ʵ�����Ϊ2��3�����ӷ�ӦΪ2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O���ʴ�Ϊ��2Fe(OH03+3ClO-+4OH-=2FeO42-+3Cl-+5H2O��
�ڷ�Ӧ��FeԪ�ػ��ϼ۱仯��+3������Ϊ+6����ÿ����1mol FeO42-ת�Ƶ���1mol����6-3��=3mol�����ڻ�ԭ����ΪCl-������Ӧ������ת����0.3mol���ӣ���ԭ��������ʵ���Ϊ![]() =0.15mol���ʴ�Ϊ��3�� 0.15��
=0.15mol���ʴ�Ϊ��3�� 0.15��
��3����Ӧ��C��0�����ߵ�������̼�е�+4�ۣ�K2Cr2O7�е�Cr��+6�۽�ΪCr2(SO4)3�е�+3�ۣ�Ҫʹ�������õ����������ڻ�ԭ��ʧȥ����������Cϵ��Ϊ3��K2Cr2O7ϵ��Ϊ2������ԭ�Ӹ����غ㣬��Ӧ�ķ���ʽ��3C+2K2Cr2O7+8H2SO4=2K2SO4+3CO2��+2Cr2(SO4)3+8H2O���ʴ�Ϊ��3��2��8��2��3��2��8��
�����ڷ�Ӧ��Ԫ�ػ��ϼ۲��䣬����ֻ�������ԣ���ѡ��C��
�����ݷ���ʽ3C+2K2Cr2O7+8H2SO4=2K2SO4+3CO2��+2Cr2(SO4)3+8H2O��ÿ����3mol������̼��ת�Ƶ�����Ϊ3mol����4-0��=12mol����������Ӧ�е���ת����0.8mol�����������������ʵ���Ϊ0.2mol����������Ϊ0.2mol��22.4L/mol=4.48L���ʴ�Ϊ��4.48��


 �����������һ��һ��ϵ�д�
�����������һ��һ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������H2��ԭWO3�Ʊ�����W��װ����ͼ��ʾ��Zn������������������ʣ�����ûʳ������Һ������������������������˵����ȷ����
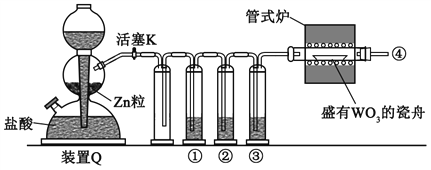
A. �١��ڡ���������ʢװKMnO4��Һ��ŨH2SO4������ûʳ������Һ
B. ��ʽ¯����ǰ�����Թ��ڢܴ��ռ����岢��ȼ��ͨ�������ж����崿��
C. ������Ӧʱ���ȹرջ���K����ֹͣ����
D. װ��Q�����շ�������Ҳ�����ڶ���������Ũ���ᷴӦ�Ʊ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
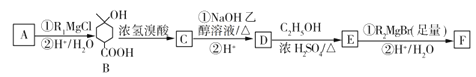
����Ŀ��ij�л���F��![]() ����һ����;�㷺���Լ����������������������ϡ�ҽҩ��ũҩ�ȡ���ҵ�Ϻϳ�����һ��·����ͼ��ʾ��R1��R2�����������
����һ����;�㷺���Լ����������������������ϡ�ҽҩ��ũҩ�ȡ���ҵ�Ϻϳ�����һ��·����ͼ��ʾ��R1��R2�����������
��֪����R'COOC2H5![]()

��![]() �������Ȼ���
�������Ȼ���![]()
![]()
��1��R2MgBr�Ļ�ѧʽΪ____________��A�Ľṹ��ʽΪ___________��F�ķ���ʽΪ________��
��2��B�й����ŵ�����Ϊ______________
��3��D��E�ķ�Ӧ������______________��
��4��д��C��NaOH���Ҵ���Һ��Ӧ�Ļ�ѧ����ʽ��__________��
��5����������������D��ͬ���칹�廹��_______�֡�
����D���ʺ�����ͬ������ �ں�����Ԫ���һ���������ȡ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ������������ͻ���������ء�����˵���������( )
A.ú����������β��ʵ�й�![]() ���ŷ���Ϊ����߿�������
���ŷ���Ϊ����߿�������
B.��Ԫ�ر���Ϊ������Ԫ�������Ӻ�ˮ����ȡ�峣���ȿ���������
C.![]() ��������������ļ�����
��������������ļ�����![]() ��
��![]() ��Ϊͬ��������
��Ϊͬ��������
D.�Ͼɸֲĺ���ǰ�ֱ��ñ���![]() ��Һ��
��Һ��![]() ��Һ�������㣬����������ˮ��ԭ��
��Һ�������㣬����������ˮ��ԭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ʼ��仯�����й㷺Ӧ�á������ѧ֪ʶͬ�����м��⣺
��1������ĽṹʽΪ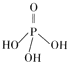 �������������Ϊ�����������֮����ȥһ��ˮ���ӵIJ�����������ƣ��׳ơ��������ơ�����һ�ֳ��õ��ӳ�����������ʱ��Ļ��������仯ѧʽΪ_____��
�������������Ϊ�����������֮����ȥһ��ˮ���ӵIJ�����������ƣ��׳ơ��������ơ�����һ�ֳ��õ��ӳ�����������ʱ��Ļ��������仯ѧʽΪ_____��
��2����ҵ�Ʊ�PH3�Ĺ����������£����ֲ����������ԣ���
������ף�P4���м������ŨNaOH��Һ������PH3����ʹ������ƣ�NaH2PO2����Һ��
����NaH2PO2��Һ���������ϡ���ᣬ�õ������ᣨH3PO2����
�����ᣨH3PO2�����ȶ��������ֽ����PH3��������ᣨH3PO4����
�ٻ����ռ���Һ��Ӧ�����ӷ���ʽΪ_____�����������жϴ���������_____���һ����������������Ԫ�ᡣ
�ڴ��������ȷֽ�Ļ�ѧ����ʽΪ_____��
����ʼʱ��1mol P4�μӷ�Ӧ����������ҵ�����й�����_____mol PH3�������Dz������ʧ����
��3���������ƣ�NaH2PO2�������ڻ�ѧ��������ѧ��������Һ�к���Ni2+��H2PO2���������������·���������Ӧ������ƽ��
_____Ni2++�� ��H2PO2��+�� ���� ���T�� ��Ni++�� ��H2PO3��+�� ���� ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�˵���������( )
A.![]() ����
����
B.�٢��У�����![]() ʱ̼Ԫ�صĻ��ϼ�δ�����仯
ʱ̼Ԫ�صĻ��ϼ�δ�����仯
C.![]() ���缫��ӦʽΪ
���缫��ӦʽΪ![]()
D.��![]() ����Ӧ
����Ӧ![]()
![]() ��֪��ÿת��
��֪��ÿת��![]() ��������
��������![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������þ����������ȼ����������������������ʯ(��Ҫ�ɷ�Ϊ![]() ����������
����������![]() ��
��![]() ������)���Ʊ�������������ͼ��ʾ��
������)���Ʊ�������������ͼ��ʾ��
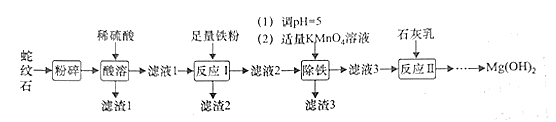
�ش���������
(1)![]() �����������ʽ�ɱ�ʾΪ_________________��
�����������ʽ�ɱ�ʾΪ_________________��
(2)��������ʱ���ʵ����ȵ�Ŀ����_____________________��
(3)����1����Ҫ�ɷ�Ϊ________(�ѧʽ)����Һ2������������������Ҫ��________��
(4)��Ӧ���м���������������������2�����ӷ���ʽ��___________��
(5)����������Ӧ�л�ԭ����Ϊ![]() �����������������з�����������ԭ��Ӧ�����ӷ���ʽΪ______��
�����������������з�����������ԭ��Ӧ�����ӷ���ʽΪ______��
(6)![]() ����Ϊ��ȼ���ϵ�ԭ��Ϊ_________(������㼴��)��
����Ϊ��ȼ���ϵ�ԭ��Ϊ_________(������㼴��)��
(7)��֪��![]() ������Һ2��
������Һ2��![]() ��ͨ���������˵����
��ͨ���������˵����![]() ʱ�Ƿ���
ʱ�Ƿ���![]() ��������__________��
��������__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
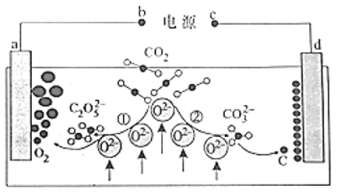
����Ŀ������ƫ�����ƣ�NaA1O2����Һ��ⷨ�Ʊ����������ļ���װ����ͼ��ʾ���������缫��Ϊ���Ե缫������˵����ȷ���ǣ� ��
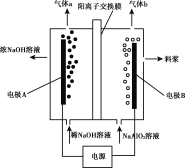
A.�缫AΪ����
B.����bΪH2
C.�����Ͻ�Һ��pH����ԭ��NaA1O2��Һ��pH
D.�÷����ܷ�Ӧ����ʽ�ǣ�4NaA1O2+10H2O![]() 4A1(OH)3+4NaOH+O2��+2H2��
4A1(OH)3+4NaOH+O2��+2H2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������������ʣ��밴Ҫ��ѡ����ʵķ�����գ�
A. O2��O3��B. ![]() ��
��![]() ��C. CH3�DCH2�DCH2�DCH3��CH3�DCH(CH3) CH3��D. ����������E. ������飻F. ���ۺ���ά��
��C. CH3�DCH2�DCH2�DCH3��CH3�DCH(CH3) CH3��D. ����������E. ������飻F. ���ۺ���ά��
��1����Ϊͬλ�ص���________________��
��2������ͬϵ�����________________��
��3����Ϊͬ���칹�����____________��
��4������ͬһ���ʵ���______________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com