
【题目】1909年化学家哈伯在实验室首次合成了氨。2007年化学家格哈德·埃特尔在哈伯研究所证实了氢气与氮气在固体表面合成氨的反应过程,示意如下图:
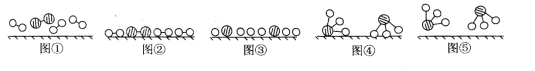
(1)图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是______,_______。
(2)已知:4NH3(g)+3O2(g)=2N2(g)+6H2O(g);ΔH=-1266.8kJ/mol,N2(g)+O2(g)=2NO(g)ΔH=+180.5kJ/mol,氨催化氧化的热化学方程式为_________________________。
(3)500℃下,在A、B两个容器中均发生合成氨的反应。隔板Ⅰ固定不动,活塞Ⅱ可自由移动。
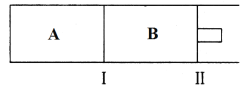
①当合成氨在容器B中达平衡时,测得其中含有1.0molN2,0.4molH2,0.4molNH3,此时容积为2.0L。则此条件下的平衡常数为________________;保持温度和压强不变,向此容器中通入0.36molN2,平衡将______________(填“正向”、“逆向”或“不”)移动。
②向A、B两容器中均通入xmolN2和ymolH2,初始A、B容积相同,并保持温度不变。若要平衡时保持N2在A、B两容器中的体积分数相同,则x与y之间必须满足的关系式为_____________。
(4)以CO和O2为电极燃料,以熔融K2CO3为电解质组成燃料电池,请写出该电池的负极反应方程式_____________________________________________。
【答案】N2和H2被吸附在催化剂表面 在催化剂表明N2和H2中化学键断裂 4NH3(g)+5O2(g)=4NO(g)+6H2O(g) H= —905.8KJ/mol 10 逆向 x=y CO-2e+CO32-=2CO2
【解析】
(1)图②表示N2、H2被吸附在催化剂表面,而图③表示在催化剂表面,N2、H2中化学键断裂;
(2)利用盖斯定律,把第二个热化学方程式两边扩大2倍,然后两个方程式相加就可以得到氨催化氧化的热化学方程式;
(3)①根据平衡常数的概念计算,根据计算的浓度商和平衡常数比较分析判断反应进行的方向;
②利用化学平衡三段式计算A的体积分数相等列式计算;
(4)根据CO在负极发生氧化反应写出电极方程式。
(1)分析题中图可以知道,图②表示N2、H2被吸附在催化剂表面,而图③表示在催化剂表面,N2、H2中化学键断裂,
故答案为:N2和H2被吸附在催化剂表面;在催化剂表面,N2和H2中化学键断裂。
(2)已知:4NH3(g)+3O2(g)=2N2(g)+6H2O(g)△H=-1266.8kJ/mol ①
N2(g)+O2(g)=2NO(g)△H=+180.5kJ/mol ②,由①+②×2得:4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=-905.8kJ/mol,故答案为:4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=-905.8kJ/mol。
(3)①若在某件下,反应A(g)+3B(g)2C(g)在容器N中达到平衡,测得容器中含有A1.0mol,B0.4mol,C0.4mol,此时容积为2.0L.则此条件下的平衡常数K=(0.4mol÷2L)2/(1mol÷2L)×(0.4mol÷2L)3=10;保持温度和压强不变,向此容器内通入0.36molA,平衡将Q=(1.36mol÷2L)2/(1mol÷2L)×(0.4mol÷2L)3=115.6>10,反应逆向进行;
故答案为:10;逆向。
②向M、N中,各通入xmolA和ymolB,初始M、N容积相同,并保持温度不变。设M容器中消耗A物质的量amol,N容器中消耗A物质的量为bmol,
M容器中,
A(g)+3B(g)2C(g)
起始量(mol) x y 0
变化量(mol) a 3a 2a
平衡量(mol) x-a y-3a 2a
N容器中,
A(g)+3B(g)2C(g),
起始量(mol) x y 0
变化量(mol) b 3b 2b
平衡量(mol)x-b y-3b 2b
若要平衡时保持A气体在M、N两容器中的体积分数相等,(x-a)/(x+y-2a)=(x-b)/(x+y-2b),x:y=(b-a):(b-a),则x:y=1:1,则起始通入容器中的A的物质的量x mol与B的物质的量y mol之间必须满足的关系式为x=y=1;故答案为:x=y。
(4)该燃料电池燃料为CO,电解质为熔融的K2CO3,总反应为2CO+O2=2CO2,CO在负极失电子发生氧化反应,负极反应方程式为:CO-2e+CO32-=2CO2,故答案为:CO-2e+CO32-=2CO2。


 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案科目:高中化学 来源: 题型:
【题目】A、B、C是中学化学常见的三种物质,它们之间的相互转化关系如图所示(部分反应条件及产物略去)。
![]()
(1)若A是一种活泼金属,C是淡黄色固体,则C的名称为________________,C可用在矿山、坑道、潜水或宇宙飞船等缺氧的场合,将人们呼出的CO2再转换成O2,以供呼吸之用,请用化学方程式表示该反应原理______________________。
(2)若A是一种黄色单质固体,则B→C的化学方程式为________________。
(3)若A为能使湿润的红色石蕊试纸变蓝的气体,C是红棕色气体,且B和C易在空气形成光化学烟雾。
①则A为________________(填写化学式,下同),C为___________________;实验室用熟石灰与氯化铵固体共热制取A,写出此化学方程式:_____________________________。
②写出C与水反应的化学方程式:____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置进行相应实验,能达到实验目的的是

A.用图1所示装置除去Cl2中含有的少量HCl
B.用图2所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体
C.用图3所示装置制取少量纯净的CO2气体
D.用图4所示装置分离CCl4萃取碘水后已分层的有机层和水层
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知五种元素的原子序数的大小顺序为C>A>B>D>E,A、C同周期,B、C同主族;A与B形成离子化合物,A2B中所有离子的电子数相同,其电子总数为30;D和E可形成4核10电子的分子。试回答下列问题:
(1)写出下列物质的电子式:
D的单质:_________________;
A、B、E形成的化合物:________________;
D、E形成的化合物:___________________。
(2)A、B两元素组成的化合物A2B2存在的化学键是_______________。
(3)铝与A的最高价氧化物的水化物在水溶液中反应的离子方程式为:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NaClO2在水溶液中能发生水解。常温时,有1 mol/L的HClO2溶液和1mol/L的HBF4(氟硼酸)溶液起始时的体积均为V0,分别向两溶液中加水,稀释后溶液的体积为V,所得曲线如图所示。下列说法错误的是
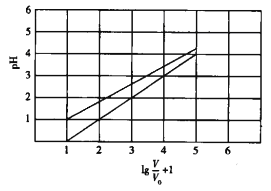
A. HClO2为弱酸,HBF4为强酸
B. 常温下HClO2的电高平衡常数的数量级为10—4
C. 在0≤pH≤5时,HBF4溶液满足pH=lg(V/V0)
D. 25℃时1L pH=2的HBF4溶液与100℃时1L pH=2的HBF4溶液消耗的NaOH相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种电镀污泥主要含有碲化亚铜(Cu2Te)、三氧化二铬(Cr2O3)以及少量的金(Au),可以用于制取Na2Cr2O7溶液、金属铜和粗碲等,以实现有害废料的资源化利用,工艺流程如下:
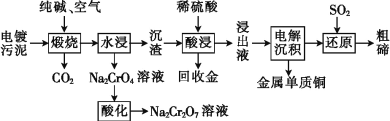
已知:煅烧时,Cu2Te发生的反应为Cu2Te+2O2![]() 2CuO+TeO2。
2CuO+TeO2。
(1)煅烧时,Cr2O3发生反应的化学方程式为__________________。
(2)浸出液中除了含有TeOSO4(在电解过程中不反应)外,还可能含有____(填化学式)。
(3)工业上用重铬酸钠(Na2Cr2O7)母液生产重铬酸钾(K2Cr2O7)的工艺流程如图所示:
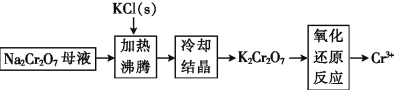
通过冷却结晶能析出大量K2Cr2O7的原因是__________________。
(4)测定产品中K2Cr2O7含量的方法如下:称取产品试样2.50 g配成250 mL溶液,用移液管取出25.00 mL于锥形瓶中,加入足量稀硫酸酸化后,再加入几滴指示剂,用0.1000 mol·L-1硫酸亚铁铵(NH4)2Fe(SO4)2标准液进行滴定,重复进行二次实验。(已知Cr2![]() 被还原为Cr3+)
被还原为Cr3+)
①氧化还原滴定过程中的离子方程式为________________。
②若三次实验消耗(NH4)2Fe(SO4)2标准液的平均体积为25.00 mL,则所得产品中K2Cr2O7的纯度为_____%。[已知M(K2Cr2O7)=294 g·mol-1,计算结果保留三位有效数字]。
(5)上述流程中K2Cr2O7发生氧化还原反应后所得溶液中除含有Cr3+外,还含有一定浓度的Fe3+杂质,可通过加碱调pH的方法使两者转化为沉淀。已知c(Cr3+)=3×10-5 mol·L-1,则当溶液中开始析出Cr(OH)3沉淀时Fe3+是否沉淀完全?____(填“是”或“否”)。{已知:Ksp[Fe(OH)3]=4.0×10-38, Ksp[Cr(OH)3]=6.0×10-31}
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下向20mL 0.1mol/L氨水中通入HCl气体,溶液中由水电离出的氢离子浓度随通入HCl气体的体积变化如图所示。则下列说法正确的是
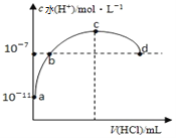
A. b点通入的HCl气体,在标况下为44.8mL
B. b、c之间溶液中c(NH4+)>c(Cl-)
C. 取10mL的c点溶液稀释时:c(NH4+)/c(NH3·H2O)减小
D. d点溶液呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标出下列氧化还原反应的电子转移数目和方向,并写出氧化剂
(1)2K2S + K2SO3 + 3H2SO4= 3K2SO4 + 3S↓+ 3H2O _______氧化剂_______
(2)2KMnO4 +5H2O2 + 3H2SO4 = K2SO4+2MnSO4+5O2↑ + 8H2O _______ 氧化剂_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中微粒的物质的量浓度关系正确的是
A. 25 ℃时,向0.1 mol·L-1 NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(NH)>c(SO![]() )>c(OH-)=c(H+)
)>c(OH-)=c(H+)
B. 25 ℃时,NaB溶液的pH=8,c(Na+)-c(B-)=9.9×10-7 mol·L-1
C. 0.1![]()
![]() 溶液:
溶液:![]()
D. 相同物质的量浓度的CH3COONa和NaClO的混合液中,各离子浓度的大小关系是:c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com