
【题目】下列事实不能用勒夏特列原理解释的是( )
A.对于2HI(g)![]() H2(g)+ I2(g),达平衡后,缩小容器体积可使体系颜色变深
H2(g)+ I2(g),达平衡后,缩小容器体积可使体系颜色变深
B.合成氨反应中为提高氨的产率,理论上应采取降低温度的措施
C.实验室配制FeCl3溶液时,将FeCl3固体加入到少量的浓盐酸中再加水稀释
D.用饱和食盐水可以去除Cl2中的HCl
科目:高中化学 来源: 题型:
【题目】科学家利用CH4燃料电池(如图)作为电源,用Cu-Si合金作硅源电解制硅可以降低制硅成本,高温利用三层液熔盐进行电解精炼,下列说法不正确的是( )
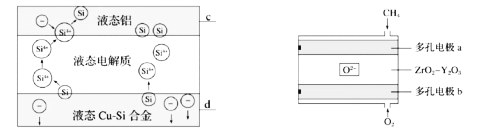
A.电极d与b相连,c与a相连
B.电解槽中,Si优先于Cu被氧化
C.a极的电极反应为CH4-8e-+8OH-=CO2+6H2O
D.相同时间下,通入CH4、O2的体积不同,会影响硅的提纯速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学是一门以实验为基础的科学。
(1)用下列实验装置完成对应的实验(部分仪器略去),能达到实验目的的是________(填字母)。
A | B | C | D |
|
|
|
|
干燥氯气 | 吸收NH3 | 石油的分馏 | 制取乙酸乙酯 |
(2)为除去粗盐中的MgCl2、CaCl2、Na2SO4以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
![]()
①第Ⅰ步操作的名称是____________。
②若第Ⅱ、Ⅳ步顺序颠倒,是否会对实验结果产生影响?________(填“有影响”或“无影响”)。
③第Ⅴ步操作所需玻璃仪器的名称是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、有一种金属单质A,焰色反应呈黄色,能发生下图所示的变化:
![]()
上图中淡黄色固体B是__________;其与H2O反应的化学方程式为__________________。写出上图中的C溶液与硝酸溶液反应的化学方程式_____________________。
II、下表是元素周期表的一部分,除标出的元素外,表中的每个编号代表一种元素。 请根据要求回答问题:

(1)②的元素符号是__________;该元素的最高价氧化物的电子式为__________;
(2)⑤和⑥两种元素的非金属性强弱关系是:⑤________⑥(填“>”或“<”);
(3)①和③两种元素组成的化合物中含有的化学键为__________(填“离子键”或“共价键”)
(4)④和⑥两种元素组成的化合物与AgNO3溶液反应的离子方程式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醛能够发生下列反应:
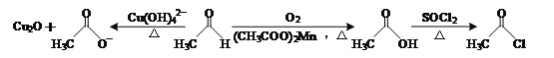
(1)Mn2+的基态电子排布式为____。
(2)氯化亚砜(SOCl2)是有机合成中重要的氯化剂,与SOCl2互为等电子体的阴离子的化学式为____。
(3)CH3CHO分子中碳原子的轨道杂化类型是____。
(4)乙酸的沸点(117.9 ℃)比乙醛的沸点(20.8 ℃)高的主要原因是____。
(5)不考虑空间构型,[Cu(OH)4]2-的结构可用示意图表示为____。
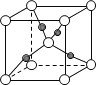
(6)如图表示Cu2O的晶胞,Cu+的配位数是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室经常利用KMnO4来检验产物或验证性质,图示为部分装置图,下列说法不正确的是
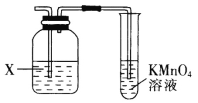
A.若X为NaOH溶液时,则KMnO4可用于溴乙烷发生消去反应的产物检验
B.若X为NaOH溶液时,则KMnO4可用于乙醇发生消去反应的产物检验
C.若X为CuSO4溶液时,则KMnO4可用于实验室制取乙炔时验证其性质
D.若X为溴水,则KMnO4可用于乙醛发生还原反应的产物检验
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种短周期主族元素,它们的原子序数依次增大,其中A元素原子核外电子仅有一种原子轨道,也是宇宙中最丰富的元素,B元素原子核外p电子数比s电子数少1,C为金属元素且原子核外p电子数和s电子数相等,D元素的原子核外所有p轨道全充满或半充满。
(1)写出四种元素的元素符号:
A________,B________,C________,D________。
(2)写出C、D两种元素基态原子核外电子轨道表示式。
C_______________________________________________________________,
D_______________________________________________________________。
(3)写出B、C两种元素单质在一定条件下反应的化学方程式____________________________________________。
(4)写出B元素单质和氢化物的电子式:单质________,氢化物__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锆(![]() )是现代工业的重要金属原料,具有良好的可塑性,抗蚀性能超过钛。以锆英石(主要成分是
)是现代工业的重要金属原料,具有良好的可塑性,抗蚀性能超过钛。以锆英石(主要成分是![]() ,还含有少量
,还含有少量![]() 等杂质)为原料生产锆及其化合物的流程如图所示
等杂质)为原料生产锆及其化合物的流程如图所示
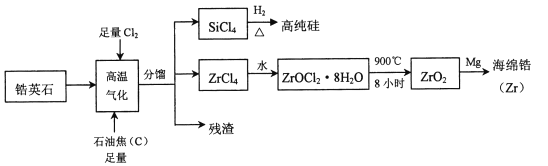
(1)写出![]() 的电子式____________________。
的电子式____________________。
(2)高温气化过程中,不考虑损失,发现分馏后得到的![]() 质量通常比由纯
质量通常比由纯![]() 发生的反应得到的
发生的反应得到的![]() 质量大,用化学方程式来解释原因_________________________。
质量大,用化学方程式来解释原因_________________________。
(3)高温气化后的固体残渣除碳外,还有![]() 和
和![]() ,加水浸取得氯化铁溶液,过滤,从滤渣中分离出碳和
,加水浸取得氯化铁溶液,过滤,从滤渣中分离出碳和![]() 两种固体的方法是____________________。
两种固体的方法是____________________。
(4)写出上述流程中![]() 与水反应的化学方程式:____________________________。
与水反应的化学方程式:____________________________。
(5)已知氧化锆(![]() )是一种两性氧化物,与氢氧化钠共熔融可形成酸盐,请写出化学方程式_________________________________________。
)是一种两性氧化物,与氢氧化钠共熔融可形成酸盐,请写出化学方程式_________________________________________。
(6)工业上可用钾还原![]() 时制得金属
时制得金属![]() ,
,![]() 被还原时生成的钾盐的物质的量为_________________。
被还原时生成的钾盐的物质的量为_________________。
(7)已知![]() ,
,![]() 。下列说法正确的是__________
。下列说法正确的是__________
A.![]() ,电解质溶液的
,电解质溶液的![]() 与
与![]() 之和均为14
之和均为14
B.用盐酸滴定某浓度的![]() 溶液,滴定过程中
溶液,滴定过程中![]() 逐渐增大
逐渐增大
C.![]() 溶液中逐滴加入硫酸溶液,滴加过程中
溶液中逐滴加入硫酸溶液,滴加过程中![]() 逐渐减小
逐渐减小
D.某温度下![]() ,则其溶液中
,则其溶液中![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式氧化(NiOOH)可用废镍催化剂(主要含Ni、Al,少量Cr、FeS等)来制备,其工艺流程如下:
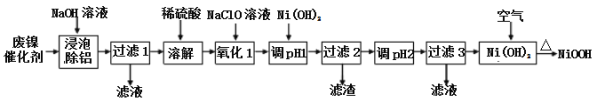
回答下列问题:
(1)“浸泡除铝”时,发生反应的离子反应方程式为_____________________。
(2)“过滤1”用到的玻璃仪器________________________________________。
(3)已知该条件下金属离子开始沉淀和完全沉淀的pH如下表:
开始沉淀的pH | 完全沉淀的pH | |
Ni2+ | 6.2 | 8.6 |
Fe2+ | 7.6 | 9.1 |
Fe3+ | 2.3 | 3.3 |
Cr3+ | 4.5 | 5.6 |
“调pH 1”时,溶液pH范围为_______________;
(4)在空气中加热Ni(OH)2可得NiOOH,请写出此反应的化学方程式________________。
(5)在酸性溶液中CrO![]() 可以转化成Cr2O
可以转化成Cr2O![]() ,用离子方程式表示该转化反应__________,已知BaCrO4的Ksp=1.2×10-10,要使溶液中CrO
,用离子方程式表示该转化反应__________,已知BaCrO4的Ksp=1.2×10-10,要使溶液中CrO![]() 沉淀完全(c(CrO
沉淀完全(c(CrO![]() )≦1×10-5mol·L1),溶液中钡离子浓度至少为________mol·L1。
)≦1×10-5mol·L1),溶液中钡离子浓度至少为________mol·L1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com