
����Ŀ��I.�ں��¡����Ϊ1.0L���ܱ�������ͨ��1.0molN2��xmolH2�������·�ӦN2(g)+3H2(g)![]() 2NH3(g)��20min��ﵽƽ�⣬��÷�Ӧ�ų�������Ϊ18.4kJ�������������ʵ���Ϊ1.6mol�������ڵ�ѹǿ��Ϊԭ����80%����ش��������⣺
2NH3(g)��20min��ﵽƽ�⣬��÷�Ӧ�ų�������Ϊ18.4kJ�������������ʵ���Ϊ1.6mol�������ڵ�ѹǿ��Ϊԭ����80%����ش��������⣺
(1)20min�ڣ�V(N2)=______��
(2)�÷�Ӧ���Ȼ�ѧ����ʽΪ____________��
(3)�����������ܱ�ʾ�÷�Ӧ�ﵽƽ��״̬����_______(�����)��
��N2����������ֲ���ڵ�λʱ�����03tmolH-H����ͬʱ����0.6molN-H��
�ۻ��������ܶȲ��ٸı��2v��(H2)=3v��(NH3)�ݻ�������ƽ��Ħ���������ٸı�
II.1883�꣬��仯ѧ�Ұ�������˹�����˵���ѧ˵����ˮ��Һ��Χ�ڶ��ᡢ�����������ܵĸ�������ش������й�ˮ��Һ�����⣺
(4) ���õ��뷽��ʽ��ʾ��ˮ��Һ�Ǽ��Ե�ԭ��________��
�������ӷ���ʽ��ʾ̼������Һ�Լ��Ե�ԭ��__________��
���𰸡�V(N2)=0.010mol/(L��min) N2(g)+3H2(g)![]() 2NH3(g)H=-92kJ/mol �٢ܢ� NH3��H2O
2NH3(g)H=-92kJ/mol �٢ܢ� NH3��H2O![]() NH4++OH- CO32-+H2O
NH4++OH- CO32-+H2O![]() HCO3-+OH-
HCO3-+OH-
��������
I.��1�����º����£�ѹǿ֮�ȵ������ʵ���֮�ȣ��ݴ˼��㷴Ӧǰ���������������ʵ��������������������ʵ����������ĵĵ���Ϊn mol����ʾ��ƽ��ʱ��������ʵ������ٸ���ƽ��ʱ������������ʵ����з��̼���n���ٸ���v=![]() ����v��N2����
����v��N2����
��2������1mol������Ӧ�ų���������ע�����ʵľۼ�״̬�뷴Ӧ����д�Ȼ�ѧ����ʽ��
��3�����淴Ӧ����ƽ��ʱ��ͬ�����ʵ�����������ȣ�����ֵ�Ũ�ȡ��������ֲ��䣬�ɴ�����������һЩ���������䣬�ж�ƽ���������Ӧ�淴Ӧ���з����仯�����������ɱ仯�����仯˵������ƽ����
II. (4) ��һˮ�ϰ���������ܲ��ֵ�������������ӣ�
��̼����Ϊǿ�������Σ�̼�������ˮ���ʹ����Һ�ʼ��ԡ�
I.��1���ں��£����Ϊ1.0L���ܱ�������ͨ��1.0molN2��xmolH2��20min��ﵽƽ�⣬�����������ʵ���Ϊ1.6mol�������ڵ�ѹǿ��Ϊԭ����80%����Ӧǰ������������ʵ���Ϊ![]() =2mol��������Ϊ2mol-1mol=1mol��
=2mol��������Ϊ2mol-1mol=1mol��
�����ĵĵ���Ϊn mol����
N2��g��+3H2��g��2NH3��g��
��ʼ����mol����1 1 0
�仯����mol����n 3n 2n
ƽ������mol����1-n 1-3n 2n
���ԣ�1-n+1-3n+2n=1.6������ó�n=0.2��v��N2��=![]() =0.010mol/(L��min)��
=0.010mol/(L��min)��
��ˣ�������ȷ���ǣ�0.010mol/(L��min)��
��2��1mol������Ӧ�ų�������Ϊ18.4kJ��![]() =92kJ��
=92kJ��
�Ȼ�ѧ����ʽΪ��N2��g��+3H2��g��2NH3��g����H=-92kJ/mol��
��ˣ�������ȷ���ǣ�N2(g)+3H2(g)![]() 2NH3(g)H=-92kJ/mol��
2NH3(g)H=-92kJ/mol��
��3���ٷ�ӦΪ���������С�ķ�Ӧ��N2�������Ϊ��������������������ֲ���ʱ��Ӧ�ﵽƽ��״̬���ʢ���ȷ��
�ڵ�λʱ���ڶ���0.3molH-H����ͬʱ����0.6molN-H��������ʾ����Ӧ���ʣ���Ӧʼ�հ��ñ�����ϵ���У��ʢڴ���
�ۻ���������������䣬�����ݻ����䣬���������ܶȲ�ʼ�ղ��䣬�ʢ۴���
��2v����H2��=3v����NH3������ͬ���ʱ�ʾ����������֮�ȵ��ڻ�ѧ������֮�ȣ���Ӧ����ƽ�⣬�ʢ���ȷ��
�ݻ�������ƽ��Ħ������Ϊ���������䲻�ٸı���Ӧ��ƽ�⣬�ʢ���ȷ��
��ˣ�������ȷ���ǣ��٢ܢݡ�
II. (4) ��һˮ�ϰ���������ܲ��ֵ�������������ӣ�����뷽��ʽΪNH3��H2O![]() NH4++OH-��
NH4++OH-��
��̼����Ϊǿ�������Σ�̼�������ˮ���ʹ����Һ�ʼ��ԣ�ˮ�ⷽ��ʽΪCO32-+H2O![]() HCO3-+OH-��
HCO3-+OH-��
��ˣ�������ȷ���ǣ�NH3��H2O![]() NH4++OH- ��CO32-+H2O
NH4++OH- ��CO32-+H2O![]() HCO3-+OH-��
HCO3-+OH-��


 ���㼤�������100�ִ��Ծ�ϵ�д�
���㼤�������100�ִ��Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���й����ʵ�ת����ϵ��ͼ��ʾ������������ͷ�Ӧ��������ȥ����D��F��G��H��Ϊ�������壬����D��ʹʪ��ĺ�ɫʯ����ֽ������G�ʻ���ɫ��H�ڿ����к�����ߣ�C��Ħ������Ϊ32g��mol��1��EΪ�����Լ
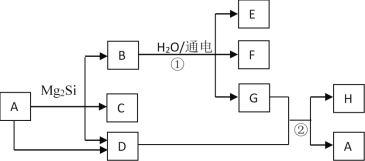
��1��C�Ļ�ѧʽΪ_________��
��2��A�ĵ���ʽΪ_________��
��3��д����Ӧ�ٵ����ӷ���ʽ_______________��
��4��д����Ӧ�ڵĻ�ѧ����ʽ________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������250mL1mol/L��ϡ������Һ����Ҫ12mol/L��Ũ��������Ϊ�� ��
A.12mLB.25mLC.20.8mLD.12.5mL
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й���Ũ����������У���ȷ����
A. Ũ���������ˮ�ԣ������ʹ����̿��
B. Ũ�����ڳ����¿�Ѹ����ͭƬ��Ӧ�ų�������������
C. Ũ������һ�ָ�������ܹ����ﰱ��������������
D. Ũ�����ڳ������ܹ�ʹ�������Ƚ����γ�����Ĥ���ۻ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A.Ħ���ǻ���������֮һ
B.1 mol H2O������������Ϊ16 g
C.10 L H2��8 L H2����H2�����ʵ�������
D.ij���ʺ���6.02��1023�����ӣ���ô��������ռ�����Ϊ22.4 L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͼ��AΪ����ɫ���壬B����������A��ͬ���������ʾ���ȥ����

�������Ϲ�ϵ���ش��������⣺
��1��A�ĵ���ʽΪ__________.
��2��AͶ��FeCl2��Һ�еķ�ӦΪ_______________(����һ����ѧ����ʽ��ʾ)
��3����A��B�����ʵ���֮��1:1.5������ܱ������м��ȳ�ַ�Ӧ���ų�����,��ʣ��Ĺ���Ϊ_____________________________(д��ѧʽ)
��4�����ܱ���Ϊ21������߷�չDZ���������Դ���Իش��������⣺
���뻯ʯȼ����ȣ�������Ϊȼ�ϵ��ŵ���__________________(������)��
��ʩ������Sehlesinger�������������NaBH4��ˮ��Ӧ��������д��NaBH4��ˮ��Ӧ�Ļ�ѧ����ʽ____________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�У����ڼӳɷ�Ӧ����
A. CH3CH=CH2+Br2![]() CH3CHBrCH2BrB. CH3CH2OH
CH3CHBrCH2BrB. CH3CH2OH ![]() CH2=CH2��+H2O
CH2=CH2��+H2O
C. CH3COOH+CH3OH![]() CH3COOCH3+H2OD.
CH3COOCH3+H2OD. ![]() +HNO3
+HNO3![]()
![]() ��NO2+H2O
��NO2+H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��W��X��Y��ZΪԪ�����ڱ��е�����Ԫ�أ���ԭ��������������20��W��ԭ���������Xλ�ڵڶ�������ԭ�ӵ��������������ڲ��������3����Y�ĵ����ڿ��������γ�һ����������Ĥ����Yԭ�ӵ�����������Ϊ������Z��Yͬ���������ڣ�W��Yԭ�ӵ�����������֮�͵���Zԭ�ӵ�����������������˵����ȷ����( )
A. ������ӵİ뾶��Y>W>X
B. ��̬�⻯����ȶ��ԣ�X>Z
C. ����������Ӧˮ����ļ��ԣ�Y>W
D. Y��Z��������������ܽ���ˮ�У��Ҿ�Ϊ����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������VB2�������������Ŀǰ����������ߵĵ�أ����ʾ��ͼ���£��õ�ع���ʱ��ӦΪ��4VB2 + 11O2 = 4B2O3 + 2V2O5������˵����ȷ����

A���缫aΪ��ظ�����������ԭ��Ӧ
B��ÿ����1molVB2ת��6mol����
C����ع���ʱ��OH��缫a�ƶ�
D��VB2�������ĵ缫��ӦΪ��2VB2+22OH��22e��V2O5+2B2O3+11H2O
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com