
【题目】配制250mL1mol/L的稀盐酸溶液,需要12mol/L的浓盐酸的体积为( )
A.12mLB.25mLC.20.8mLD.12.5mL
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列反应中亚硫酸表现的性质,其中一种与另外三种不同的是( )
A.能使酸性高锰酸钾褪色B.在空气中易被氧化变质
C.能使溴水褪色D.在溶液中加入氢氧化钡溶液产生白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第三周期元素X、Y、Z、W的最高价氧化物溶于水可得四种溶液,0.010 mol/L的这四种溶液pH与该元素原子半径的关系如图所示。下列说法正确的是
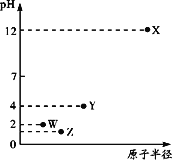
A. 简单离子半径:X>Y>Z>W
B. Y元素存在同素异形体
C. 气态氢化物的稳定性:Z>W>Y
D. X和Y的最高价氧化物对应的水化物恰好中和时,溶液呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中的两种固态物质熔化(或升华)时,克服的微粒间相互作用力属于同种类型的是( )
A.碘和碘化钠B.金刚石和大理石
C.冰醋酸和硫磺D.干冰和二氧化硅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年5月5日,中国国产大飞机C919首飞成功。为了减轻机身重量,飞机某些部件使用了镁合金。
(1)基态镁原子核外电子的轨道表达式为___________,其核外有_________种能量不同的电子。
(2)①第二电离能:Na_______Mg(填“>”“<”或“=”),其原因为______________。
②热稳定性:CaCO3>MgCO3,其原因为___________________________。
(3)镁不仅在工业生产中用途广泛,也是动植物生命活动中必不可少的微量元素,下图为叶绿素的结构示意图。

①图中与Mg形成配位键的N原子的标号为________(填写“Ⅰ”“Ⅱ”“Ⅲ”“Ⅳ”)。
②叶绿素中,碳原子的杂化形式为________。
(4)碳化镁是一种在化工行业用途广泛的金属碳化物,某种碳化镁的晶体结构如图1所示,图2为其俯视图。

①晶体中Mg的配位数为________。
②已知阿伏伽德罗常数的值为NA,据图1中计算该碳化镁的密度为________g·cm-3.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组溶液中的两个反应,可用同一离子方程式表示的是
A. BaCO3和HCl;BaCO3和H2SO4 B. BaCl2和H2SO4;Ba(OH)2和H2SO4
C. HNO3和K2CO3;HCl和NaHCO3 D. KOH和H2SO4;Ba(OH)2和HNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(H2NNH2)是一种高能燃料,有关化学反应的能量变化如下图所示。已知断裂1 mol化学键所需的能量(kJ):N≡N为942、O=O为500、N—N为154,则断裂1 mol N—H键所需的能量(kJ)是:

A. 194 B. 391 C. 516 D. 658
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.在恒温、体积为1.0L的密闭容器中通入1.0molN2和xmolH2发生如下反应N2(g)+3H2(g)![]() 2NH3(g),20min后达到平衡,测得反应放出的热量为18.4kJ,混合气体的物质的量为1.6mol,容器内的压强变为原来的80%。请回答下列问题:
2NH3(g),20min后达到平衡,测得反应放出的热量为18.4kJ,混合气体的物质的量为1.6mol,容器内的压强变为原来的80%。请回答下列问题:
(1)20min内,V(N2)=______。
(2)该反应的热化学方程式为____________。
(3)下列叙述中能表示该反应达到平衡状态的是_______(填序号)。
①N2体积分数保持不变②单位时间断裂03tmolH-H键,同时生成0.6molN-H键
③混合气体的密度不再改变④2v正(H2)=3v逆(NH3)⑤混合气体的平均摩尔质量不再改变
II.1883年,瑞典化学家阿伦尼乌斯创立了电离学说,在水溶液范围内对酸、碱作出了严密的概括。请回答下列有关水溶液的问题:
(4) ①用电离方程式表示氨水溶液是碱性的原因________;
②用离子方程式表示碳酸钠溶液显碱性的原因__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组有机物不论以何种比例混合,只要物质的量之和不变,那么完全燃烧时消耗的氧气的物质的量相等,且所生成的水的物质的量也相等的是( )
A. 甲烷和甲酸甲酯 B. 乙烷和乙酸
C. 乙炔和苯乙烯 D. 苯和苯酚
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com