
【题目】钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的1/10。
(1)钢铁腐蚀主要是吸氧腐蚀,该腐蚀过程中的电极反应式。
正极:____________;负极:________。
(2)为了降低某水库的铁闸门被腐蚀的速率,可以采用下图所示甲的方案,其中焊接在铁闸门的固体材料R可以采用___。
A、铜 B、钠 C、锌 D、石墨
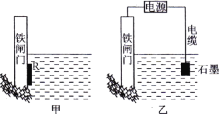
(3)上图中乙方案也可降低铁闸门腐蚀速率,其中铁闸门应该连接在直流电源的________极。
【答案】O2+4e-+2H2O=4OH- 2Fe-4e- = 2Fe2+ C 负
【解析】
(1)钢铁腐蚀主要是吸氧腐蚀,正极是氧气得电子生成氢氧根离子,负极是铁失电子生成亚铁离子;
(2)图甲的方法是牺牲阳极的阴极保护法;
(3)图乙的方法是外加电流的阴极保护法;
(1)钢铁腐蚀主要是吸氧腐蚀,正极是氧气得电子生成氢氧根离子,电极反应式是O2+4e-+2H2O=4OH-;负极是铁失电子生成亚铁离子,电极反应式是2Fe-4e- = 2Fe2+;
(2)图甲的方法是牺牲阳极的阴极保护法;A.铁与铜构成原电池,铁为负极,铁的腐蚀加快,故不选A;B.钠与水能反应,不选B;C.锌与铁构成原电池,锌被腐蚀、铁为正极,被保护,故选C;D.铁与石墨构成原电池,铁为负极,铁的腐蚀加快,故不选D;答案选C。
(3)图乙的方法是外加电流的阴极保护法,铁闸门应该连接在直流电源的负极。


 新编小学单元自测题系列答案
新编小学单元自测题系列答案 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:
【题目】为测定某有机物的结构,用核磁共振仪处理后得到如图所示的核磁共振氢谱,则该有机物可能是
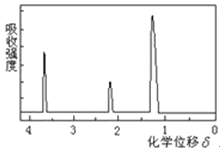
A. C2H5OHB. ![]()
C. CH3CH2CH2COOHD. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)氨为重要化工原料,有广泛用途。合成氨中的氢气可由下列反应制取:
a.CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H=+216.4KJ/mol
CO(g)+3H2(g) △H=+216.4KJ/mol
b.CO(g)+H2O(g)![]() CO2(g)+H2(g) △H=-41.2kJ/mol
CO2(g)+H2(g) △H=-41.2kJ/mol
则反应CH4(g)+2H2O(g)![]() CO2(g)+4H2(g) △H=______
CO2(g)+4H2(g) △H=______
(2)乙醇是酒精饮料的主要成分,由葡萄糖发酵生成,反应的化学方程式为:C6H12O6(aq)→2C2H5OH(aq)+2CO2(g),当C6H12O6减少的速率为0.23molL-1h-1时,C2H5OH增加的速率是__
(3)1mol CH4(l)完全燃烧生成CO2(g)与H2O(1),放出热量889.6kJ,写出反应的热化学方程式_________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物W用作调香剂、高分子材料合成的中间体等,制备W的一种合成路线如下。
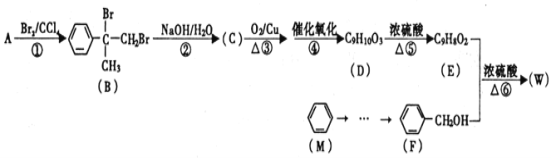
请回答下列问题:
(1)F的化学名称是________,⑤的反应类型是________。
(2)E中含有的官能团是________(写名称),D聚合生成高分子化合物的结构简式为________。
(3)将反应③得到的产物与O2在催化剂、加热的条件下反应可得D,写出反应④的化学方程式________。
(4)④、⑤两步能否颠倒?________(填“能”或“否”)理由是________。
(5)与A具有含有相同官能团的芳香化合物的同分异构体还有________种(不含立体异构),其中核磁共振氢谱为六组峰,且峰面积之比为1:1:2:2:2:2的结构简式为________。
(6)参照有机物W的上述合成路线,以N(分子式为C8H8且属于A的同系物)为原料制备 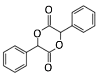 的合成路线(无机试剂任选)_________。
的合成路线(无机试剂任选)_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A为常见的金属单质,根据如图所示的关系:
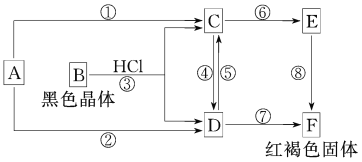
(1)确定A、B、C、D、E、F的化学式:A____________,B____________,C____________,D____________,E____________,F____________。
(2)写出⑧的化学方程式________,④、⑤的离子方程式________,_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应2SO2(g) + O2(g) ![]() 2SO3(g) ΔH = a kJ/mol,能量变化如图所示。下列说法中,不正确的是( )
2SO3(g) ΔH = a kJ/mol,能量变化如图所示。下列说法中,不正确的是( )
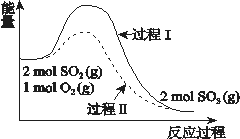
A. 2SO2(g) + O2(g) ![]() 2SO3(l) ΔH > a kJ/mol
2SO3(l) ΔH > a kJ/mol
B. 过程II可能使用了催化剂,使用催化剂不可以提高SO2的平衡转化率
C. 反应物断键吸收能量之和小于生成物成键释放能量之和
D. 将2molSO2(g) 和1mol O2(g)置于一密闭容器中充分反应后放出或吸收的热量小于┃a┃ kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增大。W的气态氢化物遇湿润的红色石蕊试纸变蓝色,X是地壳中含量最高的元素,Y在同周期主族元素中原子半径最大,Z与Y形成的化合物的化学式为YZ。下列说法不正确的是
A.W在元素周期表中的位置是第二周期VA族
B.用电子式表示的形成过程为:![]()
C.同主族中Z的气态氢化物稳定性最强
D.X与Y形成的两种常见的化合物中,阳离子和阴离子的个数比均为2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羟胺的电离方程式为:NH2OH+H2O![]() NH3OH++OH-(25℃时,Kb=9.0×10-9)。用0.lmol/L盐酸滴定20mL 0.lmol/L羟胺溶液,恒定25℃时,滴定过程中由水电离出来的H+浓度的负对数与盐酸体积的关系如图所示(己知:lg3=0.5)。下列说法错误的是( )
NH3OH++OH-(25℃时,Kb=9.0×10-9)。用0.lmol/L盐酸滴定20mL 0.lmol/L羟胺溶液,恒定25℃时,滴定过程中由水电离出来的H+浓度的负对数与盐酸体积的关系如图所示(己知:lg3=0.5)。下列说法错误的是( )
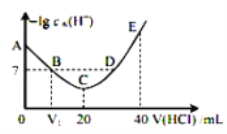
A.图中V1<10
B.A点对应溶液的pH=9.5
C.A、B、C、D四点中酸性最强的点为D点
D.E点对应溶液中存在:c(H+)=c(OH-)+c(NH3OH+)+c(NH2OH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化氢俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口。根据下列反应回答问题:
A.![]()
B.![]()
C.![]()
D.![]()
(1)上述反应中,H2O2仅体现氧化性的反应是(填序号,下同)_________,H2O2仅体现还原性的反应是(填序号,下同)_________,H2O2既体现氧化性又体现还原性的反应是________。
(2)上述反应说明H2O2、Ag2O、K2CrO4的氧化性由强到弱的顺序是________
(3)某酸性反应体系中发生的一个氧化还原的离子反应,反应物和生成物共六种微粒:![]() 。已知该反应中H2O2只发生了如下过程:H2O2→O2。
。已知该反应中H2O2只发生了如下过程:H2O2→O2。
①写出上述反应的离子方程式并配平_______________________________________
②如果上述反应中有6.72L(标准状况)气体生成,转移的电子为_______mol。
(4)H2O2有时可作为矿业废液消毒剂,有“绿色氧化剂”的美称;如消除采矿业胶液中的氰化物(如KCN),发生以下反应:![]() ,试指出生成物A的化学式为________。
,试指出生成物A的化学式为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com