
ΓΨΧβΡΩΓΩ(1)Α±ΈΣ÷Ί“ΣΜ·ΙΛ‘≠ΝœΘ§”–ΙψΖΚ”ΟΆΨΓΘΚœ≥…Α±÷–ΒΡ«βΤχΩ…”…œ¬Ν–Ζ¥”Π÷Τ»ΓΘΚ
a.CH4(g)+H2O(g)![]() CO(g)+3H2(g) ΓςH=+216.4KJ/mol
CO(g)+3H2(g) ΓςH=+216.4KJ/mol
b.CO(g)+H2O(g)![]() CO2(g)+H2(g) ΓςH=-41.2kJ/mol
CO2(g)+H2(g) ΓςH=-41.2kJ/mol
‘ρΖ¥”ΠCH4(g)+2H2O(g)![]() CO2(g)+4H2(g) ΓςH=______
CO2(g)+4H2(g) ΓςH=______
(2)““¥Φ «ΨΤΨΪ“ϊΝœΒΡ÷ς“Σ≥…Ζ÷Θ§”…ΤœΧ―Χ«ΖΔΫΆ…ζ≥…Θ§Ζ¥”ΠΒΡΜ·―ßΖΫ≥Χ ΫΈΣΘΚC6H12O6(aq)Γζ2C2H5OH(aq)+2CO2(g)Θ§Β±C6H12O6Φθ…ΌΒΡΥΌ¬ ΈΣ0.23molL-1h-1 ±Θ§C2H5OH‘ωΦ”ΒΡΥΌ¬ «__
(3)1mol CH4(l)Άξ»Ϊ»Φ…’…ζ≥…CO2(g)”κH2O(1)Θ§Ζ≈≥ω»»ΝΩ889.6kJΘ§–¥≥ωΖ¥”ΠΒΡ»»Μ·―ßΖΫ≥Χ Ϋ_________ ΓΘ
ΓΨ¥πΑΗΓΩΓςH= +175.2kJ/mol 0.46molL-1h-1 CH4(1)+2O2(g)®TCO2(g)+2H2O(l) ΓςH= -889.6 kJmol-1
ΓΨΫβΈωΓΩ
(1)ΗυΨίΗ«ΥΙΕ®¬…Ζ÷ΈωΫβ¥πΘΜ
(2)ΗυΨίΥΌ¬ ÷°±»Β»”ΎΦΤΝΩ ΐ÷°±»ΦΤΥψΘΜ
(3)ΗυΨί»»Μ·―ßΖΫ≥Χ Ϋ ι–¥ΒΡΖΫΖ® ι–¥ΓΘ
(1)a.CH4(g)+H2O(g)CO(g)+3H2(g)ΓςH= +216.4kJ/molΘ§b.CO(g)+H2O(g)CO2(g)+H2(g)ΓςH= -41.2kJ/molΘ§ΗυΨίΗ«ΥΙΕ®¬…Θ§ΫΪa+bΩ…ΒΟΘΚCH4(g)+2H2O(g)CO2(g)+4H2(g)ΓςH=(+216.4 kJ/mol)+(-41.2 kJ/mol)= +175.2kJ/molΘ§Ι ¥πΑΗΈΣΘΚ+175.2kJ/molΘΜ
(2)C6H12O6(aq)Γζ2C2H5OH(aq)+2CO2(g)Ζ¥”Π÷–C6H12O6Φθ–ΓΒΡΥΌ¬ ΈΣ0.23molL-1h-1Θ§ΗυΨίΥΌ¬ ÷°±»Β»”ΎΦΤΝΩ ΐ÷°±»Ω…÷ΣC2H5OH‘ωΦ”ΒΡΥΌ¬ «2ΓΝ0.23molL-1h-1=0.46molL-1h-1 Θ§Ι ¥πΑΗΈΣΘΚ0.46 molL-1h-1ΘΜ
(3)1mol CH4(l)Άξ»Ϊ»Φ…’…ζ≥…CO2(g)”κH2O(1)Θ§Ζ≈≥ω»»ΝΩ889.6kJΘ§Ζ≈»»Ζ¥”ΠΒΡΓςHΘΦ0Θ§‘ρΖ¥”ΠΒΡ»»Μ·―ßΖΫ≥Χ ΫΈΣCH4(l)+2O2(g)=CO2(g)+2H2O(l) ΓςH= -889.6kJ/molΘ§Ι ¥πΑΗΈΣΘΚCH4(l)+2O2(g)=CO2(g)+2H2O(l)ΓςH= -889.6kJ/molΓΘ


 Κ°ΦΌ―ß”κΝΖœΒΝ–¥πΑΗ
Κ°ΦΌ―ß”κΝΖœΒΝ–¥πΑΗ
| ΡξΦΕ | ΗΏ÷–ΩΈ≥Χ | ΡξΦΕ | ≥θ÷–ΩΈ≥Χ |
| ΗΏ“Μ | ΗΏ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ“Μ | ≥θ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏΕΰ | ΗΏΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θΕΰ | ≥θΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏ»ΐ | ΗΏ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ»ΐ | ≥θ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ‘ΎΜ·―ßΖ¥”Π÷–Θ§Ρή“ΐΖΔΜ·―ßΖ¥”ΠΒΡΖ÷Ή”Φδ≈ωΉ≤≥Τ÷°ΈΣ”––ß≈ωΉ≤Θ§’β–©Ζ÷Ή”≥ΤΈΣΜνΜ·Ζ÷Ή”ΓΘ ΙΤ’Ά®Ζ÷Ή”±δ≥…ΜνΜ·Ζ÷Ή”Υυ–ηΧαΙ©ΒΡΉνΒΆΡήΝΩΫ–ΜνΜ·ΡήΘ§ΤδΒΞΈΜ”ΟkJmol-1±μ ΨΓΘ«κ»œ’φΙέ≤λœ¬ΆΦΘ§»ΜΚσΜΊ¥πΈ ΧβΓΘ

Θ®1Θ©ΆΦ÷–Ζ¥”Π «______Θ®ΧνΓΑΈϋ»»Γ±ΜρΓΑΖ≈»»Γ±Θ©Ζ¥”ΠΘ§ΗΟΖ¥”Π_______Θ®ΧνΓΑ–η“ΣΓ±ΜρΓΑ≤Μ–η“ΣΓ±Θ©ΜΖΨ≥œ»ΧαΙ©ΡήΝΩΘ§ΗΟΖ¥”ΠΒΡΓςH=_________Θ®”ΟΚ§E1ΓΔE2ΒΡ¥ζ ΐ Ϋ±μ ΨΘ©ΓΘ
Θ®2Θ©“―÷Σ»»Μ·―ßΖΫ≥Χ ΫΘΚH2(g)+1/2O2(g) =H2O(g) ΓςH= Θ≠241.8kJmol-1Θ§ΗΟΖ¥”ΠΒΡΜνΜ·ΡήΈΣ167.2 kJmol-1Θ§‘ρΤδΡφΖ¥”ΠΒΡΜνΜ·ΡήΈΣ__________ΓΘ
Θ®3Θ©Ε‘”ΎΆ§“ΜΖ¥”ΠΘ§ΆΦ÷––ιœΏ(Δρ)”κ ΒœΏ(I)œύ±»Θ§ΜνΜ·Ρή_________Θ§ΒΞΈΜΧεΜΐΡΎΜνΜ·Ζ÷Ή”ΒΡΑΌΖ÷ ΐ________Θ§“ρ¥ΥΖ¥”ΠΥΌ¬ _________Θ§Θ®«ΑΟφΒΡ»ΐΗωΩ’ΧνΓΑ‘ω¥σΓ±ΓΑΦθ–ΓΓ±ΓΑ≤Μ±δΓ±Θ©Ρψ»œΈΣΉνΩ…ΡήΒΡ‘≠“ρ «_________________ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΔώ.œ¬Οφ «ΦΗ÷÷ Β―ι÷–≥Θ”ΟΒΡ“«ΤςΘΚ
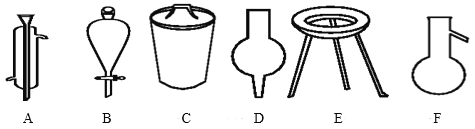
–¥≥ω–ρΚ≈Υυ¥ζ±μΒΡ“«ΤςΒΡΟϊ≥ΤΘΚ
A__ΘΜB__ΘΜC__ΘΜD___ΘΜE___F___ΓΘ
Δρ. Β―ι ““Σ≈δ÷Τ100mL1mol/LNaCl»ή“ΚΘ§«κΜΊ¥πœ¬Ν–Έ ΧβΘΚ
Θ®1Θ©≈δ÷ΤΙΐ≥Χ÷––η“Σ Ι”ΟΒΡ÷ς“Σ≤ΘΝß“«ΤςΑϋά®…’±≠ΓΔ≤ΘΝßΑτΓΔΫΚΆΖΒΈΙήΓΔΧλΤΫΓΔΝΩΆ≤ΚΆ___ΓΘ
Θ®2Θ©”ΟΆ–≈ΧΧλΤΫ≥Τ»Γ¬»Μ·ΡΤΙΧΧεΘ§Τδ÷ ΝΩΈΣ___gΓΘ
Θ®3Θ©œ¬Ν–÷ς“Σ≤ΌΉς≤Ϋ÷ηΒΡ’ΐ»ΖΥ≥–ρ «___(Χν–ρΚ≈)ΓΘ
ΔΌ≥Τ»Γ“ΜΕ®÷ ΝΩΒΡ¬»Μ·ΡΤΘ§Ζ≈»κ…’±≠÷–Θ§”Ο ΝΩ’τΝσΥ°»ήΫβΘΜ
ΔΎΦ”Υ°÷Ν“ΚΟφάκ»ίΝΩΤΩΨ±ΩΧΕ»œΏœ¬1ΓΪ2άεΟΉ ±Θ§ΗΡ”ΟΫΚΆΖΒΈΙήΒΈΦ”’τΝσΥ°÷ΝΑΦ“ΚΟφ”κΩΧΕ»œΏœύ«–ΘΜ
ΔέΫΪ»ή“ΚΉΣ“ΤΒΫ»ίΝΩΤΩ÷–ΘΜ
ΔήΗ«ΚΟΤΩ»ϊΘ§Ζ¥Η¥…œœ¬ΒΏΒΙ Θ§“Γ‘»ΘΜ
Δί”Ο…ΌΝΩ’τΝσΥ°œ¥Β”…’±≠ΡΎ±ΎΚΆ≤ΘΝßΑτ2ΓΪ3¥Έ Θ§œ¥Β”“ΚΉΣ“ΤΒΫ»ίΝΩΤΩ÷–ΓΘ
Θ®4Θ©»γΙϊ Β―ιΙΐ≥Χ÷–»±…Ό≤Ϋ÷ηΔίΘ§Μα‘λ≥…Υυ≈δ»ή“ΚΒΡΈο÷ ΒΡΝΩ≈®Ε»___(ΧνΓΑΤΪΗΏ"ΜρΓΑΤΪΒΆ"ΜρΓΑΈό”ΑœλΓ±)ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ“―÷ΣΘΚZnΘ®sΘ©+1/2O2Θ®gΘ©=ZnOΘ®sΘ© ΓςH=-350.5kJΓΛmol-1
HgΘ®lΘ©+1/2O2Θ®gΘ©=HgOΘ®sΘ© ΓςH=-90.8kJΓΛmol-1
‘ρΖ¥”ΠZnΘ®sΘ©+HgOΘ®sΘ©=ZnOΘ®sΘ©+HgΘ®lΘ©ΒΡΓςHΈΣΘ® Θ©
A. +519.4kJΓΛmol-1B. +259.7 kJΓΛmol-1
C. -259.7 kJΓΛmol-1D. -519.4kJΓΛmol-1
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΗΏΧζΥαΦΊΘ®K2FeO4Θ© «“Μ÷÷ΜΖ±ΘΓΔΗΏ–ßΓΔΕύΙΠΡή“ϊ”ΟΥ°¥ΠάμΦΝΘ§÷Τ±ΗΝς≥Χ»γΆΦΥυ ΨΘΚ
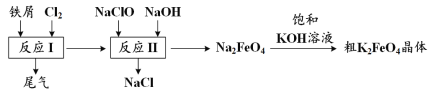
œ¬Ν––π ω≤Μ’ΐ»ΖΒΡ «
A.”ΟK2FeO4Ε‘“ϊ”ΟΥ°…±ΨζœϊΕΨΒΡΆ§ ±Θ§ΜΙ≤ζ…ζFe(OH)3ΫΚΧεΈϋΗΫ‘”÷ ΨΜΜ·Υ°
B.”ΟFeCl2»ή“ΚΈϋ ’Ζ¥”ΠI÷–Έ≤ΤχΚσΩ…‘Όάϊ”Ο
C.Ζ¥”ΠII÷–―θΜ·ΦΝ”κΜΙ‘≠ΦΝΒΡΈο÷ ΒΡΝΩ÷°±»ΈΣ3ΓΟ2
D.ΗΟ…ζ≤ζΧθΦΰœ¬Θ§Έο÷ ΒΡ»ήΫβ–‘ΘΚNa2FeO4< K2FeO4
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩFe3O4÷–Κ§”–Fe2+ΓΔFe3+Θ§Ζ÷±π±μ ΨΈΣ Fe(Δρ)ΓΔFe(Δσ)Θ§“‘Fe3O4/PdΈΣ¥ΏΜ·≤ΡΝœΘ§Ω… Βœ÷”Ο H2œϊ≥ΐΥα–‘ΖœΥ°÷–ΒΡ÷¬Α©Έο NO2-Θ§ΤδΖ¥”ΠΙΐ≥Χ Ψ“βΆΦ»γΆΦΥυ ΨΘ§œ¬Ν–ΥΒΖ®≤Μ’ΐ»ΖΒΡ «
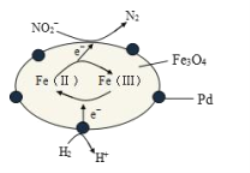
A.”ΟΗΟΖ®¥ΠάμΚσΥ°ΧεΒΡ pHΫΒΒΆ
B.Fe(Δρ)”κ Fe(Δσ)ΒΡœύΜΞΉΣΜ·ΤπΒΫΝΥ¥ΪΒίΒγΉ”ΒΡΉς”Ο
C.Ζ¥”ΠΙΐ≥Χ÷–NO2-±Μ Fe(Δρ)ΜΙ‘≠ΈΣ N2
D.Pd …œΖΔ…ζΒΡΒγΦΪΖ¥”ΠΈΣΘΚH2- 2eΘ≠== 2HΘΪ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΕ‘”Ύ≥®ΩΎ»ίΤς÷–ΒΡΖ¥”ΠΘΚZn(s)+H2SO4(aq)= ZnSO4 (aq)+H2(g)Θ§œ¬Ν––π ω÷–≤Μ’ΐ»ΖΒΡ «
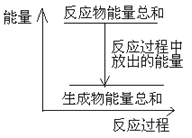
A. ZnΚΆH2SO4ΒΡΉήΡήΝΩ¥σ”Ύ ZnSO4ΚΆH2ΒΡΉήΡήΝΩ
B. Ζ¥”ΠΙΐ≥Χ÷–ΡήΝΩΙΊœΒΩ…”Ο…œΆΦ±μ Ψ
C. »τΫΪΗΟΖ¥”Π…ηΦΤ≥…‘≠Βγ≥ΊΘ§‘ρZnΈΣΗΚΦΪ
D. »τΫΪΗΟΖ¥”Π…ηΦΤ≥…‘≠Βγ≥ΊΘ§Β±”–65g–Ω»ήΫβ ±Θ§’ΐΦΪΖ≈≥ω11.2LΤχΧε
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΗ÷ΧζΚή»ί“Ή…ζ–βΕχ±ΜΗ· ¥Θ§ΟΩΡξ“ρΗ· ¥ΕχΥπ ßΒΡΗ÷≤Ρ’Φ άΫγΗ÷ΧζΡξ≤ζΝΩΒΡ1/10ΓΘ
Θ®1Θ©Η÷ΧζΗ· ¥÷ς“Σ «Έϋ―θΗ· ¥Θ§ΗΟΗ· ¥Ιΐ≥Χ÷–ΒΡΒγΦΪΖ¥”Π ΫΓΘ
’ΐΦΪΘΚ____________ΘΜΗΚΦΪΘΚ________ΓΘ
Θ®2Θ©ΈΣΝΥΫΒΒΆΡ≥Υ°ΩβΒΡΧζ’ΔΟ≈±ΜΗ· ¥ΒΡΥΌ¬ Θ§Ω…“‘≤…”Οœ¬ΆΦΥυ ΨΦΉΒΡΖΫΑΗΘ§Τδ÷–ΚΗΫ”‘ΎΧζ’ΔΟ≈ΒΡΙΧΧε≤ΡΝœRΩ…“‘≤…”Ο___ΓΘ
AΓΔΆ≠ BΓΔΡΤ CΓΔ–Ω DΓΔ ·ΡΪ
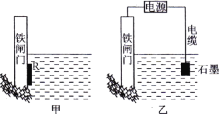
Θ®3Θ©…œΆΦ÷–““ΖΫΑΗ“≤Ω…ΫΒΒΆΧζ’ΔΟ≈Η· ¥ΥΌ¬ Θ§Τδ÷–Χζ’ΔΟ≈”ΠΗΟΝ§Ϋ”‘Ύ÷±ΝςΒγ‘¥ΒΡ________ΦΪΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΡ≥–ΓΉιάϊ”ΟH2C2O4»ή“ΚΚΆΥα–‘KMnO4»ή“ΚΖ¥”Πά¥ΧΫΨΩΓΑΧθΦΰΕ‘Μ·―ßΖ¥”ΠΥΌ¬ ΒΡ”ΑœλΓ±ΓΘ Β―ι ±Θ§œ»Ζ÷±πΝΩ»ΓΝΫ÷÷»ή“ΚΘ§»ΜΚσΒΙ»κ ‘Ιή÷–―ΗΥΌ’ώΒ¥Θ§ΜλΚœΨυ‘»Θ§ΩΣ ΦΦΤ ±Θ§Ά®Ιΐ≤βΕ®Ά …ΪΥυ–η ±Φδά¥≈–ΕœΖ¥”ΠΒΡΩλ¬ΐΓΘΗΟ–ΓΉι…ηΦΤΝΥ»γœ¬ΖΫΑΗΘΚ
±ύΚ≈ | H2C2O4»ή“Κ | Υα–‘KMnO4»ή“Κ | Έ¬Ε»/Γφ | ||
≈®Ε»Θ®mol/LΘ© | ΧεΜΐ/mL | ≈®Ε»Θ®mol/LΘ© | ΧεΜΐ/mL | ||
ΔΌ | 0.10 | 2.0 | 0.01 | 4.0 | 25 |
ΔΎ | 0.20 | 2.0 | 0.01 | 4.0 | 25 |
Δέ | 0.20 | 2.0 | 0.01 | 4.0 | 50 |
Θ®1Θ©“―÷ΣΖ¥”ΠΚσH2C2O4ΉΣΜ·ΈΣCO2“ί≥ωΘ§ΈΣΝΥΙέ≤λΒΫΉœ…ΪΆ »ΞΘ§H2C2O4”κKMnO4≥θ ΦΒΡΈο÷ ΒΡΝΩ–η“Σ¬ζΉψΒΡΙΊœΒΈΣΘΚn(H2C2O4)ΓΟn(KMnO4) ______________ΓΘ
Θ®2Θ©ΧΫΨΩΈ¬Ε»Ε‘Μ·―ßΖ¥”ΠΥΌ¬ ”ΑœλΒΡ Β―ι±ύΚ≈ «_______ Θ®Χν±ύΚ≈Θ§œ¬Ά§Θ©Θ§Ω…ΧΫΨΩΖ¥”ΠΈο≈®Ε»Ε‘Μ·―ßΖ¥”ΠΥΌ¬ ”ΑœλΒΡ Β―ι±ύΚ≈ « ________.
Θ®3Θ© Β―ιΔΌ≤βΒΟKMnO4»ή“ΚΒΡΆ …Ϊ ±ΦδΈΣ40sΘ§Κω¬‘ΜλΚœ«ΑΚσ»ή“ΚΧεΜΐΒΡΈΔ–Γ±δΜ·Θ§’βΕΈ ±ΦδΡΎΤΫΨυΖ¥”ΠΥΌ¬ v(KMnO4)=_______ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΙζΦ ―ß–Θ”≈―Γ - ΝΖœΑ≤αΝ–±μ - ‘ΧβΝ–±μ
Κΰ±± ΓΜΞΝΣΆχΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΤΫΧ® | Άχ…œ”–ΚΠ–≈œΔΨΌ±®Ή®«χ | Βγ–≈’©Τ≠ΨΌ±®Ή®«χ | …φάζ Ζ–ιΈό÷ς“ε”–ΚΠ–≈œΔΨΌ±®Ή®«χ | …φΤσ«÷»®ΨΌ±®Ή®«χ
ΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΒγΜΑΘΚ027-86699610 ΨΌ±®” œδΘΚ58377363@163.com