
【题目】高铁酸钾(K2FeO4)是一种环保、高效、多功能饮用水处理剂,制备流程如图所示:
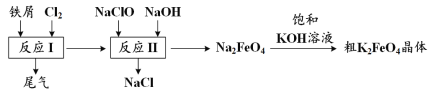
下列叙述不正确的是
A.用K2FeO4对饮用水杀菌消毒的同时,还产生Fe(OH)3胶体吸附杂质净化水
B.用FeCl2溶液吸收反应I中尾气后可再利用
C.反应II中氧化剂与还原剂的物质的量之比为3∶2
D.该生产条件下,物质的溶解性:Na2FeO4< K2FeO4
【答案】D
【解析】
铁与氯气反应生成氯化铁,加入NaClO、NaOH,次氯酸钠将铁离子在碱性条件下氧化成Na2FeO4,加入饱和KOH溶液可析出高铁酸钾(K2FeO4),分离得到粗K2FeO4,采用重结晶、洗涤、低温烘干将其提纯,以此解答该题。
A. K2FeO4具有强氧化性,可用于杀菌消毒,生成的铁离子可水解生成具有吸附性的氢氧化铁胶体,可用于净水,故A正确;
B. 尾气含有氯气,可与氯化亚铁反应生成氯化铁,可再利用,故B正确;
C. 反应中Cl元素化合价由+1价降低为-1价,Fe元素化合价由+3价升高到+6价,则氧化剂与还原剂的物质的量之比为3:2,故C正确;
D. 结晶过程中加入浓KOH溶液,增大了K+浓度,该温度下,高铁酸钾的溶解度比高铁酸钠的溶解度小,有利于K2FeO4晶体的析出,故D错误;
故选D。


科目:高中化学 来源: 题型:
【题目】研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。
(1)利用CO2和CH4重整可制合成气(主要成分为CO、H2),已知重整过程中部分反应的热化学方程式为:
Ⅰ.CH4(g)![]() C(s)+2H2(g) ΔH=+75.0 kJ·mol1
C(s)+2H2(g) ΔH=+75.0 kJ·mol1
Ⅱ.CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH=+41.0 kJ·mol1
CO(g)+H2O(g) ΔH=+41.0 kJ·mol1
Ⅲ.CO(g)+H2(g)![]() C(s)+H2O(g) ΔH=131.0 kJ·mol1
C(s)+H2O(g) ΔH=131.0 kJ·mol1
①反应CO2(g)+CH4(g)![]() 2CO(g)+2H2(g)的ΔH=_________kJ·mol1。
2CO(g)+2H2(g)的ΔH=_________kJ·mol1。
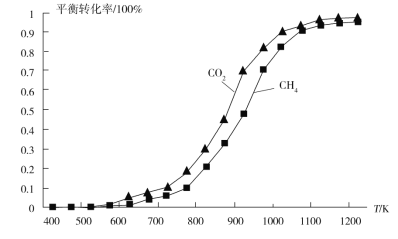
②固定n(CO2)=n(CH4),改变反应温度,CO2和CH4的平衡转化率如图所示。同温度下CO2的平衡转化率大于CH4的平衡转化率,其原因是_______________。
(2)研究发现,化石燃料在O2和CO2的混合气体中燃烧与在空气中燃烧相比,烟气中NOx的排放量明显降低,其主要原因是_________________________。
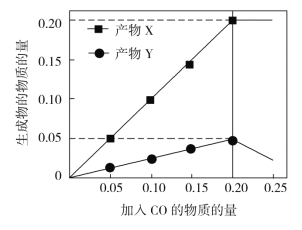
(3)为研究“CO还原SO2”的新技术,在反应器中加入0.10 mol SO2,改变加入CO的物质的量,反应后体系中产物物质的量随CO物质的量的变化如图所示。反应的化学方程式为__________。
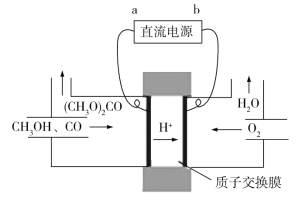
(4)碳酸二甲酯[(CH3O)2CO]毒性小,是一种绿色化工产品,用CO合成(CH3O)2CO,其电化学合成原理为4CH3OH+2CO+O2![]() 2(CH3O)2CO+2H2O,装置如图所示,直流电源的负极为________(填“a”或“b”);阳极的电极反应式为_____________。
2(CH3O)2CO+2H2O,装置如图所示,直流电源的负极为________(填“a”或“b”);阳极的电极反应式为_____________。
(5)用PdCl2溶液可以检验空气中少量的CO。当空气中含CO时,溶液中会产生黑色的Pd沉淀。若反应中有0.02 mol电子转移,则生成Pd沉淀的质量为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质之间的化学反应,反应产物一定为纯净物的是( )
A. 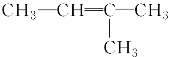 ―→
―→
B. CH2===CH—CH2—CH3+HCl![]()
C. CH3—CH===CH2+H2O![]()
D. nCH2===CH2+nCH2===CH—CH3![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:
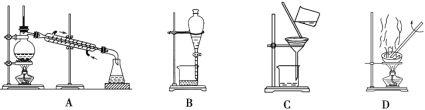
(1)从氯化钾溶液中得到氯化钾固体,选择装置________(填代表装置图的字母,下同);除去自来水中的Cl等杂质,选择装置________。
(2)从碘水中分离出I2,选择装置________,该分离方法的名称为________。
(3)装置A中①的名称是________,进水的方向是从________(填“上”或“下”)口进水。装置B在操作时为使液体顺利滴下,除打开下端活塞外,还应进行的具体操作是________________________________。
(4)为了除去KCl中的Ca2+、Mg2+、![]() 及泥沙,得到纯净的KCl,可将混合物溶于水,然后在下列操作中选取必要的步骤和正确的操作顺序进行提纯,正确的步骤及顺序是___________。
及泥沙,得到纯净的KCl,可将混合物溶于水,然后在下列操作中选取必要的步骤和正确的操作顺序进行提纯,正确的步骤及顺序是___________。
①过滤 ②加过量NaOH溶液 ③加适量盐酸 ④加过量Na2CO3溶液 ⑤加过量BaCl2溶液 ⑥加过量KOH溶液 ⑦加过量K2CO3溶液
A.②⑤④①③ B.⑥⑤⑦①③ C.④①②⑤③ D.④②⑤①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学为探究H2O2、H2SO3、Br2的氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验)。

实验记录如下:
实验操作 | 实验现象 | |
Ⅰ | 打开活塞a,滴加氯水,关闭活塞a | A中溶液变为红棕色 |
Ⅱ | 吹入热空气 | A中红棕色明显变浅;B中有气泡,产生大量白色沉淀,混合液颜色无明显变化 |
Ⅲ | 停止吹入空气,打开活塞b,逐滴加入H2O2溶液 | 开始时颜色无明显变化;继续滴加H2O2溶液,一段时间后,混合液逐渐变成红棕色 |
请回答下列问题:
(1)A中反应的离子方程式是______。
(2)实验操作Ⅱ吹入热空气的目的是_____。
(3)装置C的作用是_____,C中盛放的药品是_____。
(4)实验操作Ⅲ,混合液逐渐变成红棕色,其对应的离子方程式是_____。
(5)由上述实验得出的结论是______。
(6)实验反思:
①有同学认为实验操作Ⅱ吹入的热空气,会干扰(5)中结论的得出,你认为是否干扰,理由是________。
②实验操作Ⅲ,开始时颜色无明显变化的原因是(写出一条即可)______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于原子结构的说法中正确的是
A.卢瑟福根据![]() 粒子散射现象提出“葡萄干面包式”的原子结构模型
粒子散射现象提出“葡萄干面包式”的原子结构模型
B.原子中,核对核外电子吸引作用实质是核内的质子对核外电子的吸引
C.质子数决定元素的种类,中子数决定核素的种类
D.所有的原子都含有质子、中子和电子3种基本粒子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将3 mol A和3 mol B混合于2 L的密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g)+2D(g),经5 min后,测得D的浓度为0.5 mol/L,C的平均反应速率为0.15 mol/(L·min)。试求:
xC(g)+2D(g),经5 min后,测得D的浓度为0.5 mol/L,C的平均反应速率为0.15 mol/(L·min)。试求:
(1)5 min后A的浓度__________________。
(2)B的平均反应速率为___________________。
(3)x的值为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方案设计中,无法达到实验目的的是
选项 | 实验目的 | 实验方案 |
A | 除去NaCl固体中少量的KNO3杂质 | 将固定溶于水配成溶液,蒸发结晶并趁热过滤 |
B | 检验乙酸乙酯中是否含有乙酸 | 加入含有酚酞的NaOH溶液并振荡,观察下层溶液颜色变化 |
C | 证明Na2CO3溶液中存在水解平衡 | 向含有酚酞的Na2CO3溶液中滴入BaCl2溶液,观察溶液的变化 |
D | 比较Fe3+和I2的氧化性强弱 | 向含有淀粉的KI溶液中滴入FeCl3溶液,观察溶液颜色变化 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅蓄电池是最常见的二次电池。由于铅蓄电池的性能优良、价格低廉、安全可靠,可多次充放电,所以在生产生活中使用广泛,汽车等机动车辆多数都使用这种蓄电池。
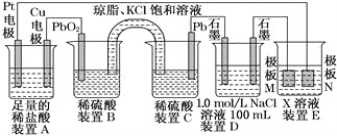
(1)装置B中PbO2上发生的电极反应方程式为______________。
(2)装置A中总反应的离子方程式为____________。
(3)盐桥中的______(填离子符号)向装置C中溶液方向移动。
(4)若装置E中的目的是精炼铜,则X为________,极板M的材料为________(填“粗铜”或“精铜”)。M电极质量改变6.4g时,N极质量变化_________6.4g,(填“大于”、 “小于”、“等于”或“无法确定”),装置D中产生的气体体积为_______L(标准状况下),溶液的pH______(填“增大”或“减小”,忽略溶液体积变化)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com