
【题目】研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。
(1)利用CO2和CH4重整可制合成气(主要成分为CO、H2),已知重整过程中部分反应的热化学方程式为:
Ⅰ.CH4(g)![]() C(s)+2H2(g) ΔH=+75.0 kJ·mol1
C(s)+2H2(g) ΔH=+75.0 kJ·mol1
Ⅱ.CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH=+41.0 kJ·mol1
CO(g)+H2O(g) ΔH=+41.0 kJ·mol1
Ⅲ.CO(g)+H2(g)![]() C(s)+H2O(g) ΔH=131.0 kJ·mol1
C(s)+H2O(g) ΔH=131.0 kJ·mol1
①反应CO2(g)+CH4(g)![]() 2CO(g)+2H2(g)的ΔH=_________kJ·mol1。
2CO(g)+2H2(g)的ΔH=_________kJ·mol1。
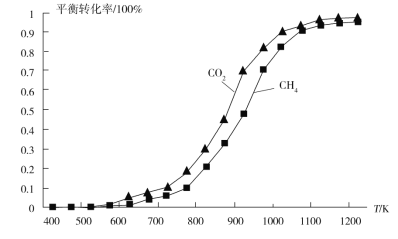
②固定n(CO2)=n(CH4),改变反应温度,CO2和CH4的平衡转化率如图所示。同温度下CO2的平衡转化率大于CH4的平衡转化率,其原因是_______________。
(2)研究发现,化石燃料在O2和CO2的混合气体中燃烧与在空气中燃烧相比,烟气中NOx的排放量明显降低,其主要原因是_________________________。
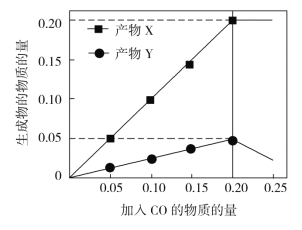
(3)为研究“CO还原SO2”的新技术,在反应器中加入0.10 mol SO2,改变加入CO的物质的量,反应后体系中产物物质的量随CO物质的量的变化如图所示。反应的化学方程式为__________。
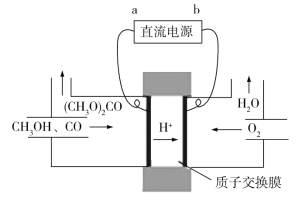
(4)碳酸二甲酯[(CH3O)2CO]毒性小,是一种绿色化工产品,用CO合成(CH3O)2CO,其电化学合成原理为4CH3OH+2CO+O2![]() 2(CH3O)2CO+2H2O,装置如图所示,直流电源的负极为________(填“a”或“b”);阳极的电极反应式为_____________。
2(CH3O)2CO+2H2O,装置如图所示,直流电源的负极为________(填“a”或“b”);阳极的电极反应式为_____________。
(5)用PdCl2溶液可以检验空气中少量的CO。当空气中含CO时,溶液中会产生黑色的Pd沉淀。若反应中有0.02 mol电子转移,则生成Pd沉淀的质量为_______________。
【答案】+247 CO2发生了其他副反应 CO2代替了N2,减少了N2与O2反应 4CO+2SO2![]() 4CO2+S2 b 2CH3OH+CO2e
4CO2+S2 b 2CH3OH+CO2e![]() (CH3O)2CO+2H+ 1.06 g
(CH3O)2CO+2H+ 1.06 g
【解析】
(1)分析题中重整过程中部分反应的热化学方程式,可根据盖斯定律计算目标反应的焓变值。分析图中转化率曲线,当n(CO2)=n(CH4),CO2的转化率大于CH4,分析重整过程中部分反应的热化学方程式Ⅱ,可知CO2会和H2发生副反应。
(2)相比空气,O2和CO2的混合气体中没有N2,CO2代替了N2,减少了N2与O2反应;
(3)分析题给信息,随着CO的物质的量的增大,生成物X、Y的生成量逐渐增大,但产物X的生成量大于产物Y的生成量。在CO的物质的量为0.20mol时,产物X的生成量保持不变,产物Y的生成量变小。在CO的物质的量为0.20mol时,生成产物X、Y的物质的量分别为0.20mol和0.05mol,根据质量守恒,推断X、Y的成分,进而得出反应方程式。
(4)由图可知,该装置为电解池,根据电解池原理,与电源负极相连的为阴极,发生还原反应,与电源正极相连的为阳极,发生氧化反应,根据电解池中阳离子向阴极移动,可判断出电解池的阴极。根据题给的总反应方程式,写出电极反应方程式。
(5)依据生成Pd质量,结合PdCl2~Pd~2e-,计算分析。
(1)根据盖斯定律,由①+②③得到反应CO2(g)+CH4(g)![]() 2CO( g)+2H2(g) ΔH=+247 kJ/mol;根据图示可知,CO2发生了其他副反应,同温度下CO2的平衡转化率大于CH4的平衡转化率;答案为:①+247;②CO2发生了其他副反应;
2CO( g)+2H2(g) ΔH=+247 kJ/mol;根据图示可知,CO2发生了其他副反应,同温度下CO2的平衡转化率大于CH4的平衡转化率;答案为:①+247;②CO2发生了其他副反应;
(2)CO2代替了N2,减少了N2与O2反应;答案为:CO2代替了N2,减少了N2与O2反应;
(3)根据图中信息,若以CO投入量为0.2 mol,则为0.10 mol SO2与0.20 mol CO反应生成0.05 mol Y和0.2 mol X,且“CO还原SO2”,则X与Y中有一种是CO2,根据质量守恒可知X为CO2,则Y只含有硫元素,应该为S2;故反应的化学方程式为:4CO+2SO2![]() 4CO2+S2;答案为:4CO+2SO2
4CO2+S2;答案为:4CO+2SO2![]() 4CO2+S2;
4CO2+S2;
(4)在电解池中,阳离子向阴极移动,可以得出b为直流电源的负极;阳极氧化失电子,电极反应式为2CH3OH+CO2e==(CH3O)2CO+2H+;答案为:b;2CH3OH+CO2e![]() (CH3O)2CO+2H+;
(CH3O)2CO+2H+;
(5)若空气中含CO,溶液中会产生黑色的Pd沉淀。依据PdCl2~Pd~2e,每转移2 mol电子,生成106 g Pd沉淀,共0.02 mol电子转移,则生成沉淀的质量=![]() =1.06 g。答案为:1.06 g。
=1.06 g。答案为:1.06 g。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】有关下图所示化合物的说法不正确的是 ( )
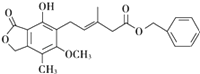
A. 既可以与Br2的CCl4溶液发生加成反应,又可以在光照下与Br2发生取代反应
B. 1mol该化合物最多可以与1molNa反应
C. 既可以催化加氢,又可以使酸性KMnO4溶液褪色
D. 既可以与FeCl3溶液发生显色反应,又可以与NaHCO3溶液反应放出CO2气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分。表中所列的字母分别代表某一化学元素。
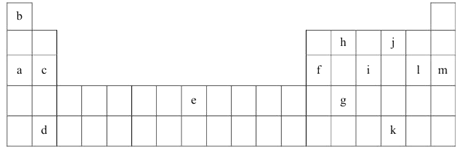
(1)上述元素的单质可能是电的良导体的是_______(填字母代号)。
(2)下表是一些气态原子的第一、二、三、四级电离能(kJ·mol-1):
锂 | X | Y | |
第一电离能 | 519 | 502 | 580 |
第二电离能 | 7296 | 4570 | 1820 |
第三电离能 | 11799 | 6920 | 2750 |
第四电离能 | 9550 | 11600 |
①通过上述信息和表中的数据分析为什么锂原子失去核外第二个电子时所需的能量要远远大于失去第一个电子所需的能量:______________________________________。
②表中的Y可能为以上13种元素中的_________(填元素符号)元素,用元素符号表示X和j按原子个数1:1形成化合物的电子式___________________________。
(3)根据构造原理,用电子排布式表示e的核外电子排布式_______________。
(4)以上13种元素中,________(填元素符号)元素原子失去核外第一个电子需要的能量最多。
(5)a、e、f三种元素的最高价氧化物的水化物显碱性,其碱性最强的为_______(用化学符号作答)。f的氧化物具有两性,写出其与NaOH溶液反应的离子方程式___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】贝诺酯是一种新型抗炎、解热、镇痛药,其结构如下所示。下列对该化合物叙述正确的是
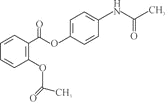
A. 贝诺酯分子式为![]()
B. 贝诺酯属于芳香烃
C. 贝诺酯属于高分子化合物
D. 已知贝诺酯的水解产物之一为对氨基乙酰酚(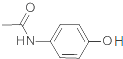 ),在核磁共振氢谱中,对氨基乙酰酚有5种峰
),在核磁共振氢谱中,对氨基乙酰酚有5种峰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】萜类化合物广泛存在于动植物体内,关于下列萜类化合物的说法正确的是( )

A. a和b都属于芳香族化合物
B. a和c分子中所有碳原子均处于同一平面上
C. a、b和c均能使酸性KMnO4溶液褪色
D. b和c均能与新制的Cu(OH)2反应生成红色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芳香化合物A是一种基本化工原料,可以从煤和石油中得到。A、B、C、D、E的转化关系如图所示:回答下列问题:
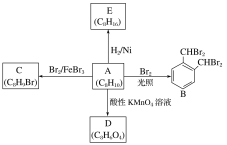
⑴A的化学名称是______;与A互为同分异构体的芳香化合物还有 _____种,其中核磁共振氢谱图上显示有5个峰,且峰面积之比为1:2:2:2:3的物质的结构简式为:________________。
⑵A→B的反应类型是_______。
⑶A→E的化学方程式为____________________。
⑷A与酸性KMnO4溶液反应可得到D,写出D的结构简式:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,容积为2 L的密闭容器中,将2 mol M气体和3 mol N气体混合发生下列反应2M(g)+ 3N(g)![]() xQ(g)+ 3R(g),该反应达到平衡时生成2.4 mol R,并测得Q浓度为0.4 mol/L,下列叙述正确的是
xQ(g)+ 3R(g),该反应达到平衡时生成2.4 mol R,并测得Q浓度为0.4 mol/L,下列叙述正确的是
A.x值为2
B.混合气体的密度增大
C.平衡时N的浓度为 0.6 mol/L
D.N的转化率为80%
查看答案和解析>>
科目:高中化学 来源: 题型:
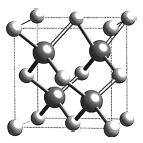
【题目】镓(Ga)、锗(Ge)、硅(Si)、硒(Se)的单质及某些化合物如砷化镓、磷化镓等都是常用的半导体材料。回答下列问题:
(1)基态硒原子的核外电子排布式为[Ar]__________,核外电子占据的最高能层的符号是________________。
(2)砷与锗、硒是同周期主族元素,该三种元素的第一电离能由大到小的顺序为_______________________。
(3)单晶锗具有金刚石结构,其原子之间存在的作用力为__________________。
(4)水晶的主要成分是二氧化硅,在水晶中硅原子的配位数是____________。硅与氢结合能形成一系列的二元化合物SiH4、Si2H6等,与氯、溴结合能形成SiCl4、SiBr4,上述四种物质沸点由高到低顺序为_______________,丁硅烯(Si4H8)中![]() 键与
键与![]() 键个数之比为______________。
键个数之比为______________。
(5)已知GaCl3的熔点77. 9 °C ,沸点201°C ; GeCl4的熔点 -49. 5 °C ,沸点84 °C,则GaCl3的晶体类型为______________,GaCl3的杂化轨道类型为_____________,GeCl4的空间构型为_________________。
(6)砷化稼的晶胞结构如图所示,若该晶体密度为![]() ]则晶胞参数a =_____________cm (用NA表示阿伏加德罗常数)。
]则晶胞参数a =_____________cm (用NA表示阿伏加德罗常数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种环保、高效、多功能饮用水处理剂,制备流程如图所示:
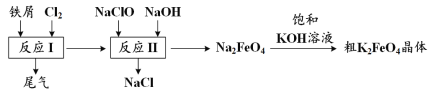
下列叙述不正确的是
A.用K2FeO4对饮用水杀菌消毒的同时,还产生Fe(OH)3胶体吸附杂质净化水
B.用FeCl2溶液吸收反应I中尾气后可再利用
C.反应II中氧化剂与还原剂的物质的量之比为3∶2
D.该生产条件下,物质的溶解性:Na2FeO4< K2FeO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com