
【题目】纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的四种方法:
方法a | 用炭粉在高温条件下还原CuO |
方法b | 用葡萄糖还原新制的Cu(OH)2制备Cu2O |
方法c | 电解法,反应为 |
方法d | 用肼(N2H4)还原新制的Cu(OH)2 |
(1)已知:①2Cu(s)+![]() O2(g)=Cu2O(s);△H = -169kJ·mol-1
O2(g)=Cu2O(s);△H = -169kJ·mol-1
②C(s)+![]() O2(g)=CO(g);△H = -110.5kJ·mol-1
O2(g)=CO(g);△H = -110.5kJ·mol-1
③Cu(s)+![]() O2(g)=CuO(s);△H = -157kJ·mol-1
O2(g)=CuO(s);△H = -157kJ·mol-1
则方法a发生反应的热化学方程式是:____________。
(2)方法c采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示:

该离子交换膜为__________离子交换膜(填“阴”或“阳”),该电池的阳极反应式为___________,钛极附近的pH值______(填“增大”“减小”或“不变”)。
(3)方法d为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2。该制法的化学方程式为________。
【答案】2CuO(s)+C(s)=Cu2O(s)+CO(g) ΔH=+34.5kJ/mol 阴 2Cu-2e-+2OH-= Cu2O+H2O 增大 4Cu(OH)2+N2H4![]() 2Cu2O+6H2O+N2↑
2Cu2O+6H2O+N2↑
【解析】
(1)根据盖斯定律并结合热化学方程式的书写方法来书写;
(2)方法c采用离子交换膜控制电解液中OH-的浓度,则只有使用阴离子交换膜才能控制氢氧根离子的浓度,在电解池的阳极发生失电子的氧化反应;钛极是阴极发生氢离子得电子的还原反应,据此分析附近pH值的变化;
(3)根据“液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2”来书写化学方程式。
(1)已知:①2Cu(s) +![]() O2(g)=Cu2O(s);△H= -169kJ/mol,
O2(g)=Cu2O(s);△H= -169kJ/mol,
②C(s)+![]() O2(g)=CO(g);△H= -110.5kJ/mol,
O2(g)=CO(g);△H= -110.5kJ/mol,
③Cu(s)+![]() O2(g)═CuO(s);△H= -157kJ/mol,
O2(g)═CuO(s);△H= -157kJ/mol,
用炭粉在高温条件下还原CuO制取Cu2O和CO的化学方程式为2CuO(s)+C(s)=Cu2O(s)+CO(g),该反应可以由②-③×2+①得到,则反应的焓变为-110.5 kJ/mol –(-157 kJ/mol×2)-169 kJ/mol=34.5 kJ/mol;
(2)方法c采用离子交换膜控制电解液中OH-的浓度,则只有使用阴离子交换膜才能控制氢氧根离子的浓度;在电解池中,铜电极连接电源的正极,则铜电极作阳极,且根据总反应式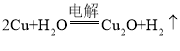 知,铜作阳极失去电子生成Cu2O,则在碱性环境下,阳极的电极反应式为2Cu-2e- +2OH- = Cu2O+H2O,钛极是阴极,发生还原反应,氢离子得电子,电极反应式为2H2O+2e- = H2↑+2OH-,所以氢氧根离子浓度增大,则pH值增大;
知,铜作阳极失去电子生成Cu2O,则在碱性环境下,阳极的电极反应式为2Cu-2e- +2OH- = Cu2O+H2O,钛极是阴极,发生还原反应,氢离子得电子,电极反应式为2H2O+2e- = H2↑+2OH-,所以氢氧根离子浓度增大,则pH值增大;
(3)根据题目信息:液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2,依据得失电子守恒、元素守恒,写出化学方程式为:4Cu(OH)2+N2H4![]() 2Cu2O+6H2O+N2↑。
2Cu2O+6H2O+N2↑。


科目:高中化学 来源: 题型:
【题目】Ⅰ.充分燃烧2.8g某有机物A,生成8.8g CO2和3.6g H2O,这种有机物蒸气的相对密度是相同条件下N2的2倍。
(1)该有机物的分子式_______________,A的链状同分异构体共有__________种。
(2)A的链状同分异构体中含有支链的同分异构体的结构简式为_______________,其系统命名为__________________
(3)若该有机物跟HCl的加成产物只有一种,试确定其结构简式___________________
(4)若该有机物在核磁共振氢谱中只有一个信号峰(即只有一种氢原子),则用键线式表示的结构简式为___________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将250mL含BaCl2和KCl的混合溶液分成5等份,取一份加入含a mol硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含b mol硝酸银的溶液,恰好使氯离子完全沉淀。则原混合溶液中钾离子物质的量浓度为
A. 4(b-2a)mol/L B. 20(2a-b)mol/L
C. 20(b-2a)mol/L D. 10(b-a)mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】连二亚硫酸钠![]() ,俗称保险粉,易溶于水,常用于印染、纸张漂白等。回答下列问题:
,俗称保险粉,易溶于水,常用于印染、纸张漂白等。回答下列问题:
(1)![]() 中S的化合价为______。
中S的化合价为______。
(2)向锌粉的悬浮液中通入![]() ,制备
,制备![]() ,生成
,生成![]()
![]() ,反应中转移的电子数为____mol;向
,反应中转移的电子数为____mol;向![]() 溶液中加入适量
溶液中加入适量![]() ,生成
,生成![]() 并有沉淀产生,该反应的化学方程式为_________
并有沉淀产生,该反应的化学方程式为_________
(3)![]() 电池具有高输出功率的优点。其正极为可吸附
电池具有高输出功率的优点。其正极为可吸附![]() 的多孔碳电极,负极为金属锂,电解液为溶解有
的多孔碳电极,负极为金属锂,电解液为溶解有![]() 的碳酸丙烯酯-乙腈溶液。电池放电时,正极上发生的电极反应为
的碳酸丙烯酯-乙腈溶液。电池放电时,正极上发生的电极反应为![]() ,电池总反应式为____________。该电池不可用水替代混合有机溶剂,其原因是_______________。
,电池总反应式为____________。该电池不可用水替代混合有机溶剂,其原因是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2008年质检部门在众多品牌乳制品中检出有毒有机物三聚氰胺[C3N3(NH2)3],在乳制品行业掀起了一场轩然大波,引发了一场关于食品安全问题的大讨论。三聚氰胺是一种重要的有机化工原料,因其含氮量高而被不法商家用作食品添加剂,以提升食品检测中的蛋白质含量指标(N%),因此三聚氰胺也被人称为“蛋白精”。三聚氰胺遇强酸或强碱水溶液水解,胺基逐步被羟基取代,最后生成三聚氰酸[C3N3(OH)3]。三聚氰酸可用于消除汽车尾气中的NO2。其反应原理为:![]() ;
;![]() ,下列说法正确的是( )
,下列说法正确的是( )
A. C3N3(OH)3与HNCO为同一物质B. HNCO是一种很强的氧化剂
C. 1mol NO2在反应中转移的电子为4molD. 反应中NO2是还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物的说法正确的是( )
A.乙醇和丙三醇互为同系物
B.环己烯(![]() )分子中的所有碳原子共面
)分子中的所有碳原子共面
C.分子式为C5H10O2,且属于酯的同分异构体共有9种(不考虑立体异构)
D.二环己烷( ![]() )的二氯代物有6种结构(不考虑立体异构)
)的二氯代物有6种结构(不考虑立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列反应的化学方程式:
(1)苯酚钠溶液中通少量的CO2 :______。
(2)由甲苯制TNT :_____________。
(3)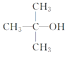 的消去反应:________。
的消去反应:________。
(4)![]() 的水解反应:______。
的水解反应:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】18.0 mol·L-1的浓硫酸稀释成2.00 mol·L-1的稀硫 酸100 ml,实验操作如下:
(1)计算并用量筒量取 ml的18.0 mol·L-1的浓硫酸;
(2)将 沿烧杯内壁慢慢注入盛有少量 的烧杯中;
(3)将已冷却至室温的硫酸溶液沿玻璃棒注入 ___________;
(4)用少量蒸馏水洗涤烧杯2~3次,并将洗涤液也全部转移到容量瓶中;
(5)继续向容量瓶中加蒸馏水,直到液面接近刻度线1~2cm处,改用胶头滴管逐滴加蒸馏水,至液面与刻度线相切
(6)盖好容量瓶塞,反复颠倒摇匀,将配好的稀硫酸倒入试剂瓶中,贴好标签保存。
试分析下列操作对实验结果的影响(偏高、偏低或无影响)
①没有洗涤烧杯和玻璃棒
②定容时俯视读数
③容量瓶使用前有少许水残留
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物的水溶液中,只可能含有以下离子中的若干种:K+、NH4+、Cl-、H+、Ba2+、CO32-、SO42-,现取三份100mL该溶液进行实验:
①第一份加入AgNO3溶液有沉淀产生。
②第二份加足量NaOH溶液加热后,收集到气体0.04mol。
③第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g。
根据上述实验数据,填写下列空白。
(1)一定不存在的离子有_________。
(2)第②步操作发生反应的离子方程式为_________。
(3)第③步操作确定的离子有_________。
(4)无法确定是否存在的离子是_________,若满足n(K+)________0.02mol(填“>”、“<”或“=”)时,能确定其存在。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com