
【题目】下列关于有机物的说法正确的是( )
A.乙醇和丙三醇互为同系物
B.环己烯(![]() )分子中的所有碳原子共面
)分子中的所有碳原子共面
C.分子式为C5H10O2,且属于酯的同分异构体共有9种(不考虑立体异构)
D.二环己烷( ![]() )的二氯代物有6种结构(不考虑立体异构)
)的二氯代物有6种结构(不考虑立体异构)
【答案】C
【解析】
A.乙醇是饱和一元醇,甘油是饱和三元醇,所含官能团数目不同,因此二者不是同系物,A错误;
B.环己烯分子中含有4个饱和碳原子,由于甲烷的分子结构中与该C原子连接的四个原子构成的是四面体结构,所以该物质分子中的所有碳原子不可能同一个平面上,B错误;
C.分子式为C5H10O2的酯为饱和一元酯,若为甲酸与丁醇形成的酯有4种,HCOOCH2CH2CH2CH3、HCOOCH2CH(CH3)2、HCOOCH(CH3)CH2CH3、HCOOC(CH3)3;若为乙酸和丙酯,有2种,CH3COOCH2CH2CH3、CH3COOCHCH(CH3)2;若为丙酸和乙醇形成的酯,只有1种,CH3CH2COOCH2CH3;若为丁酸和甲醇形成的酯,有2种,CH3CH2CH2COOCH3、(CH3)2CHCOOCH3,所以属于酯的同分异构体共有(4+2+1+2)=9种,C正确;
D.二环己烷有2种不同位置的H原子,其二氯取代产物中,若2个Cl原子在同一个C原子上,只有1种结构,若在两个不同的C原子上,有6种不同的结构,乙醇其二氯代物共有7种,D错误;
故合理选项是C。


科目:高中化学 来源: 题型:
【题目】氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下:
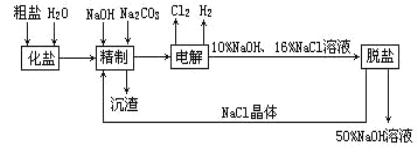
依据上图,完成下列填空:
(1)在电解过程中,与电源正极相连的电极上所发生的电极反应式为_______;与电源负极相连的电极附近,溶液pH______(选填:不变、升高或下降)。
(2)如果粗盐中SO42-含量较高,必须加钡剂除去,该钡试剂可以是______
a.Ba(OH)2 b.Ba(NO3)2 c.BaCl2
(3)工业食盐含Ca2+、Mg2+等杂质,精制过程发生反应的离子方程式为______、_______
(4)电解饱和食盐水的总反应化学方程式为_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知短周期元素 A、B、C、D、E 的最高价氧化物对应的水化物分别为 X、Y、M、Z、W,B 是短周期主族元素中原子半径最大的元素,常温下 X、Y、Z、W 均可与 M 反应,A、B、D、E 的原子序数及其对应 0.1mol/L X、Y、Z 、W 溶液的 pH 如图所示。
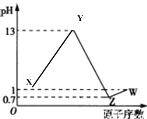
下列说法正确的是:
A. D的简单气态氢化物的热稳定性大于E的气态氢化物热稳定性
B. A、B、C 三种元素简单离子半径的大小顺序为C>B>A
C. Y 的稀溶液与 Z 或 W 的稀溶液分别发生中和反应时,对应的中和热在数值上相等
D. Y与W 两物质的化学键类型相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微型银-锌电池可用作电子仪器的电源,其电极分别是![]() 和
和![]() ,电解质
,电解质![]() 溶液,电池总反应为
溶液,电池总反应为![]() ,下列说法正确的是( )
,下列说法正确的是( )
A. 电池工作过程中,![]() 溶液浓度降低
溶液浓度降低
B. 电池工作过程中,电解液中![]() 向正极迁移
向正极迁移
C. 负极发生反应![]()
D. 正极发生反应![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的四种方法:
方法a | 用炭粉在高温条件下还原CuO |
方法b | 用葡萄糖还原新制的Cu(OH)2制备Cu2O |
方法c | 电解法,反应为 |
方法d | 用肼(N2H4)还原新制的Cu(OH)2 |
(1)已知:①2Cu(s)+![]() O2(g)=Cu2O(s);△H = -169kJ·mol-1
O2(g)=Cu2O(s);△H = -169kJ·mol-1
②C(s)+![]() O2(g)=CO(g);△H = -110.5kJ·mol-1
O2(g)=CO(g);△H = -110.5kJ·mol-1
③Cu(s)+![]() O2(g)=CuO(s);△H = -157kJ·mol-1
O2(g)=CuO(s);△H = -157kJ·mol-1
则方法a发生反应的热化学方程式是:____________。
(2)方法c采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示:

该离子交换膜为__________离子交换膜(填“阴”或“阳”),该电池的阳极反应式为___________,钛极附近的pH值______(填“增大”“减小”或“不变”)。
(3)方法d为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2。该制法的化学方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.电解精炼铜时,若转移2NA个电子,则阳极减少的质量为64g
B.合成氨生产中将NH3液化分离,可加快正反应速率,提高H2的转化率
C.![]() 在常温下能自发进行,则该反应的△H>0
在常温下能自发进行,则该反应的△H>0
D.常温下,![]() 。欲使溶液中
。欲使溶液中![]() ,需调节溶液的
,需调节溶液的![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是( )
A. 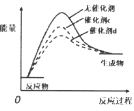 催化剂活性
催化剂活性![]()
B. 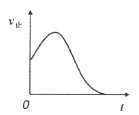
![]()
![]() ,在恒容绝热容器中投入一定量
,在恒容绝热容器中投入一定量![]() 和
和![]() ,正反应速率随时间变化
,正反应速率随时间变化
C. 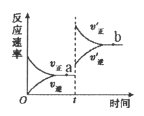
![]()
![]() ,t时刻改变某一条件,则
,t时刻改变某一条件,则![]()
D. 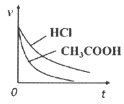 向等体积等pH的HCl和
向等体积等pH的HCl和![]() 中加入等量且足量Zn,反应速率的变化情况
中加入等量且足量Zn,反应速率的变化情况
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用粗盐(含Ca2+、Mg2+、![]() 等杂质)为主要原料采用“侯氏制碱法”生产纯碱和化肥NH4Cl,工艺流程如下图所示,下列有关说法正确的是( )
等杂质)为主要原料采用“侯氏制碱法”生产纯碱和化肥NH4Cl,工艺流程如下图所示,下列有关说法正确的是( )
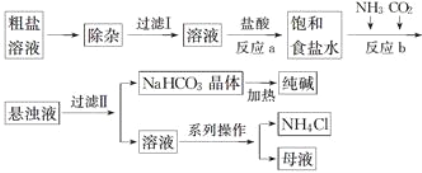
A. 在“侯氏制碱法”中涉及到了氧化还原反应
B. 饱和食盐水中先通入的气体为CO2
C. 流程图中的系列操作中一定需要玻璃棒
D. 工艺中只有碳酸氢钠加热分解产生的CO2可回收循环利用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用菱锰矿(MnCO3)[含FeCO3、SiO2、Cu2(OH)2CO3等杂质]为原料制取二氧化锰,其流程示意图如下:
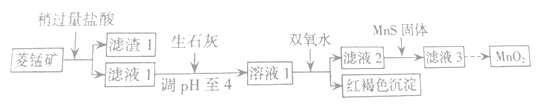
已知生成氢氧化物沉淀的pH:
Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
开始沉淀时 | 8.3 | 6.3 | 2.7 | 4.7 |
完全沉淀时 | 9.8 | 8.3 | 3.7 | 6.7 |
注:金属离子的起始浓度为0.1mol/L
回答下列问题:
(1)含杂质的菱锰矿使用前需将其粉碎,主要目的是_____________;盐酸溶解MnCO3的离子方程式为___________;
(2)向溶液1中加入双氧水,反应的离子方程式是 ______________________________;
(3)滤液2中加入稍过量的难溶电解质MnS,以除去Cu2+,反应的离子方程式为_______________;
(4)将MnCl2转化为MnO2的一种方法是氧化法,其具体做法是用酸化的NaClO3溶液将MnCl2氧化,该反应的离子方程式:5Mn2+ + 2ClO3- + ____ =______+ ____+ ____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com