
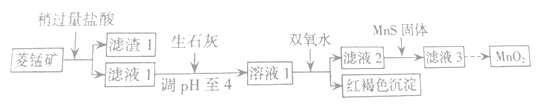
【题目】工业上用菱锰矿(MnCO3)[含FeCO3、SiO2、Cu2(OH)2CO3等杂质]为原料制取二氧化锰,其流程示意图如下:
已知生成氢氧化物沉淀的pH:
Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
开始沉淀时 | 8.3 | 6.3 | 2.7 | 4.7 |
完全沉淀时 | 9.8 | 8.3 | 3.7 | 6.7 |
注:金属离子的起始浓度为0.1mol/L
回答下列问题:
(1)含杂质的菱锰矿使用前需将其粉碎,主要目的是_____________;盐酸溶解MnCO3的离子方程式为___________;
(2)向溶液1中加入双氧水,反应的离子方程式是 ______________________________;
(3)滤液2中加入稍过量的难溶电解质MnS,以除去Cu2+,反应的离子方程式为_______________;
(4)将MnCl2转化为MnO2的一种方法是氧化法,其具体做法是用酸化的NaClO3溶液将MnCl2氧化,该反应的离子方程式:5Mn2+ + 2ClO3- + ____ =______+ ____+ ____。
【答案】增大接触面积,加快反应速率 MnCO3 + 2H+ =Mn2+ + CO2 ↑+H2O 2Fe2+ + H2O2 + 4H2O=2Fe(OH)3↓+4H+ MnS + Cu2+ =CuS + Mn2+ 4H2O 5MnO2 Cl2 ↑ 8H+
【解析】
菱锰矿中加入过量的盐酸,SiO2不溶于盐酸,进入滤渣1,MnCO3、FeCO3、Cu2(OH)2CO3和盐酸反应生成MnCl2、FeCl2和CuCl2,在滤液1中。加入生石灰调节pH=4,再加入双氧水,把Fe2+氧化为Fe3+,在pH=4的溶液中Fe3+完全沉淀为Fe(OH)3而除去。向滤液中加入MnS,把铜离子沉淀除去。滤液经处理,最后得到MnO2。
(1)粉碎菱锰矿的主要目的是增大接触面积,加快反应速率;盐酸和MnCO3发生复分解反应,离子方程式为MnCO3 + 2H+ =Mn2+ + CO2 ↑+H2O。故答案为:增大接触面积,加快反应速率,MnCO3 + 2H+ =Mn2+ + CO2 ↑+H2O;
(2)向溶液1中加入双氧水的目的是把Fe2+氧化为Fe3+,在PH=4的溶液中Fe3+完全沉淀为Fe(OH)3,反应的离子方程式是2Fe2+ + H2O2 + 4H2O=2Fe(OH)3↓+4H+;
(3)滤液2中加入稍过量的难溶电解质MnS,以除去Cu2+,发生沉淀的转化,反应的离子方程式为MnS + Cu2+ =CuS + Mn2+;
(4)用酸化的NaClO3溶液将MnCl2转化为MnO2,5molMn2+转化为MnO2失去10mol电子,2mol ClO3-也应得到10mol电子,所以ClO3-的还原产物中Cl的化合价为0价,即为Cl2。再根据电荷守恒和溶液呈酸性,需要生成H+,最后根据质量守恒,反应中有水参加。配平的离子方程式为:5Mn2+ + 2ClO3- + 4H2O=5MnO2+Cl2 ↑+8H+。故答案为:4H2O,5MnO2,Cl2 ↑,8H+。


科目:高中化学 来源: 题型:
【题目】下列关于有机物的说法正确的是( )
A.乙醇和丙三醇互为同系物
B.环己烯(![]() )分子中的所有碳原子共面
)分子中的所有碳原子共面
C.分子式为C5H10O2,且属于酯的同分异构体共有9种(不考虑立体异构)
D.二环己烷( ![]() )的二氯代物有6种结构(不考虑立体异构)
)的二氯代物有6种结构(不考虑立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)用正确的序号填空: ①12C、13C、14C; ②红磷和白磷; ③H2O和D2O;④CH3CH2OH与CH3OCH3; ⑤CH4和CH3CH3;
互为同位素的是 ; 互为同素异形体的是 ;
互为同分异构体的是 ; 互为同系物的是
(2)由A、B、C、D四种金属按下表中装置进行实验。
装置 |
|
|
|
现象 | 金属A不 | C的质 | A上有气 |
根据实验现象回答下列问题:
①装置甲中作正极的是________ (填“A”或“B”) 。
②装置乙溶液中Cu2+向_______极移动(填“B”或“C”)。
③装置丙中金属A上电极反应属于______(填“氧化反应”或“还原反应”)。
④四种金属活动性由强到弱的顺序是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知部分弱酸的电离平衡常数如下表:

下列离子方程式正确的是( )
A. 少量CO2通入NaClO溶液中:CO2 + H2O + 2ClO-===CO32-+ 2HClO
B. 少量的SO2通入Ca(ClO)2溶液中:SO2 + H2O + Ca2+ + 2ClO-===CaSO3↓+2HClO
C. 少量的SO2通入Na2CO3溶液中:SO2 + H2O + 2CO32-===SO32-+ 2HCO3-
D. 相同浓度NaHCO3溶液与NaHSO3溶液等体积混合:H+ + HCO3-===CO2↑+ H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物的水溶液中,只可能含有以下离子中的若干种:K+、NH4+、Cl-、H+、Ba2+、CO32-、SO42-,现取三份100mL该溶液进行实验:
①第一份加入AgNO3溶液有沉淀产生。
②第二份加足量NaOH溶液加热后,收集到气体0.04mol。
③第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g。
根据上述实验数据,填写下列空白。
(1)一定不存在的离子有_________。
(2)第②步操作发生反应的离子方程式为_________。
(3)第③步操作确定的离子有_________。
(4)无法确定是否存在的离子是_________,若满足n(K+)________0.02mol(填“>”、“<”或“=”)时,能确定其存在。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是NaCl、MgSO4的溶解度曲线。下列说法正确的是 ( )
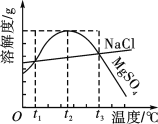
A. 只有在t1 ℃时,NaCl和MgSO4的溶解度才相等
B. t1~t2 ℃,MgSO4的溶解度随温度升高而减小
C. 在t2 ℃时,MgSO4饱和溶液的溶质质量分数最大
D. 把MgSO4饱和溶液的温度从t3 ℃降至t2 ℃时,有晶体析出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卫生部严令禁止在面粉生产中添加过氧化钙(CaO2)等食品添加剂。过氧化钙(CaO2)常用作杀菌剂、防腐剂,是一种白色固体,带有结晶水,通常还含有CaO。
I、制备过氧化钙。
某实验小组选用如下装置制备过氧化钙。已知化学反应Ca2++H2O2+2NH3+xH2O===CaO2·xH2O↓+2NH4+。在碱性环境中制取CaO2·xH2O的装置如下图:
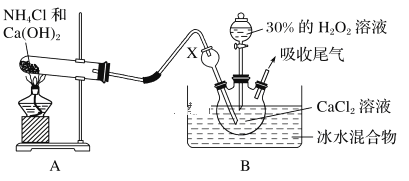
(1)装置B中仪器X的作用是_____________;反应在冰水浴中进行的原因是_________________。
(2)反应结束后,经________、________、低温烘干获得CaO2·xH2O。
II、含量测定。
(1)称取13.52 g过氧化钙样品,灼热时发生如下反应:2[CaO2·xH2O]→2CaO+O2↑+2xH2O,得到O2在标准状况下体积为672 mL,该样品中CaO2的物质的量为____________。
(2)另取同一样品13.52 g,溶于适量稀盐酸中,然后加入足量的Na2CO3溶液,将溶液中Ca2+全部转化为CaCO3沉淀,得到干燥的CaCO3 7.0 g。样品中杂质CaO的质量为_____________;样品CaO2·xH2O中的x值为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一种新型的乙醇电池,它用磺酸类质子溶剂,在200 ℃左右时供电,乙醇电池比甲醇电池效率高出32倍且更安全。电池总反应为C2H5OH+3O2===2CO2+3H2O,电池示意如图,下列说法不正确的是( )

A. a极为电池的负极
B. 电池工作时,电流由b极沿导线经灯泡再到a极
C. 电池正极的电极反应为4H++O2+4e-===2H2O
D. 电池工作时,1 mol乙醇被氧化时就有6 mol电子转移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸松油酯是松油醇的酯化产物,具有甜香气味,广泛应用于日用和食用香精中。乙酸松油酯的结构简式如图甲所示,下列说法正确的是

A. 乙酸松油酯的分子式为C12H22O2
B. 乙酸松油酯的水解产物松油醇与图乙所示物质互为同分异构体
C. 乙酸松油酯既易溶于水、也易溶于乙醇或油脂
D. 乙酸松油酯能使Br2的CCl4溶液或酸性KMnO4溶液褪色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com