
【题目】某无色溶液能溶解Al(OH)3,则此溶液中一定能大量共存的离子组是
A. Fe2+、Cl-、Na+、NO3- B. K+、Na+、NO3-、HCO3-
C. Na+、Ba2+、Cl-、NO3- D. Na+、K+、AlO2-、SO42-
 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源: 题型:
【题目】【2016上海卷】异戊二烯是重要的有机化工原料,其结构简式为CH2=C(CH3)CH=CH2。
完成下列填空:
(1)化合物X与异戊二烯具有相同的分子式,与Br2/CCl4反应后得到3-甲基-1,1,2,2-四溴丁烷。X的结构简式为_______________。
(2)异戊二烯的一种制备方法如下图所示:

A能发生的反应有___________。(填反应类型)
B的结构简式为______________。
(3)设计一条由异戊二烯制得有机合成中间体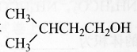 的合成路线。
的合成路线。
(合成路线常用的表示方式为:![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤作为主要的能源物质,在国民生产和生活中起重要作用,但直接排放煤燃烧产生的烟气会引起严重的环境问题,将烟气通过装有石灰石(主要成分:CaCO3)浆液的脱硫装置可以除去其中的 SO2气体,最终生成硫酸钙。硫酸钙可在如图所示的循环燃烧装置的燃料反应器中与甲烷反应,气体产物分离出水后得到几乎不含杂质的二氧化碳,从而有利于 CO2的回收利用,达到减少碳排放的目的。

请回答下列问题:
(1)煤燃烧产生的烟气直接排放在空气中,不会引发的环境问题是(______)
A. 温室效应 B. 酸雨 C. 粉层污染 D. 水体富营养化
(2)在烟气脱硫的过程中,所用的石灰石浆液在进入脱硫装置前,需通过一段时间的CO2,以增加脱硫效率;脱硫时控制浆液的pH值,此时浆液含有的Ca(HSO3)2可以快速被氧化为CaSO4。
①从分子结构看,CO2是由_____ 共价键构成的_____分子(选填:“极性”或“非极性”)。它与石灰石浆液反应的属于 _________反应。(选填“化合”、“分解”、“置换”、“复分解”),固体的CO2被称为干冰,其受热很容易_______。(填一种物理现象)
②Ca(HSO3)2从晶体类型看属于_____晶体,它溶于蒸馏水的电离方程式为______________________,它与足量氧气反应生成硫酸氢钙的化学方程式是_________________。用单线桥表示出反应物中电子转移的数目和方向:____________________。
③回收的CO2与酚羟基的钠盐在一定条件下反应,生成有机物M,其化学式为C7H5O3Na,M经过稀硫酸酸化后得到一种药物中间体N,N的结构简式为:

M的结构简式为________________除苯基外,药物中间体N所含的官能团还有______________(填写“中文名称”)N在一定条件下可以经过自身缩聚形成一种高分子化合物,试写出形成高分子的化学反应:__________________。分子中无 -O-O- ,醛基与苯环直接相连的N的同分异构体共有_______种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图将锌片和铜片用导线连接后放入稀硫酸溶液中,发生原电池反应,下列叙述错误的是

A.溶液的pH增大 B.溶液中的Zn2+浓度增大
C.溶液中的SO42-浓度增大 D.溶液的密度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苹果汁是人们喜爱的饮料。由于此饮料中含有Fe2+,现榨苹果汁在空气中会由淡绿色(Fe2+) 变为棕黄色(Fe3+)。若榨汁时加入维生素C,可有效防止这种现象发生。这说明维生素C具有( )
A.氧化性 B.还原性 C.碱性 D.酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于钠元素的单质及其化合物的叙述错误的是( )
A.钠是银白色金属,氧化钠是白色粉末,过氧化钠是淡黄色粉末
B.大量的钠着火时可以用沙扑灭,不能用水或泡沫灭火剂灭火
C.金属钠在空气中长期放置,最终变为碳酸钠。
D.Na2O和Na2O2都能由金属钠和氧气化合生成,Na2O和Na2O2氧的价态也相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛矿工业中的酸性废水富含Ti、Fe等元素,其综合利用如下:

已知:TiO2+易水解,只能存在于强酸性溶液中。
(1)TiO2+钛的化合价为
(2)步骤I中检验钛矿废水中加入铁屑是否足量的试剂是 。
(3)操作a是蒸发浓缩、冷却结晶、 。
(4)步骤Ⅲ中发生反应的化学方程式为____________;反应温度一般需控制在35℃以下,其目的是 。
(5)已知![]() s。步骤Ⅲ中,FeCO3达到溶解平衡时,若室温下测得溶液的pH为8.5,c(Fe2+)=1×10-6 mol/L。试判断所得的FeCO3中________(填“有”或“没有”)Fe(OH)2;步骤Ⅳ中,为了得到较为纯净的Fe2O3,除了适当的温度外,还需要采取的措施是 。
s。步骤Ⅲ中,FeCO3达到溶解平衡时,若室温下测得溶液的pH为8.5,c(Fe2+)=1×10-6 mol/L。试判断所得的FeCO3中________(填“有”或“没有”)Fe(OH)2;步骤Ⅳ中,为了得到较为纯净的Fe2O3,除了适当的温度外,还需要采取的措施是 。
(6)向“富含TiO2+溶液”中加入Na2CO3粉末得到固体TiO2·nH2O。请结合原理和化学用语解释其原因 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下的定容密闭容器中,当物质的下列物理量不再变化时,不能说明反应A(s) + 2B(g)![]() C(g) + D(g) 已达平衡状态的是
C(g) + D(g) 已达平衡状态的是
A. 混合气体的压强 B. 混合气体的密度
C. B的物质的量浓度 D. 气体的平均相对分子质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇为原料制备环己烯。
已知:


⑴制备粗品:
将12.5mL环己醇加入试管A中,再加入l mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是_________________,导管B除了导气外还具有的作用是______________________。
②试管C置于冰水浴中的目的是________________
③从环己醇的水溶液中获得较纯净的环己醇的方法是______________
⑵某烃X能使溴的CCl4溶液褪色,1molX完全燃烧时消耗9molO2并生成等物质的量的CO2与H2O,又知X中仅含有2个甲基,则符合上述条件的X结构最多有_______种。经测定,该烃X的核磁共振氢谱示意图如图,则X的结构简式为(写其中一种即可):

________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com