
| 容器 编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
| CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
| I | 387 | 0.20 | 0.080 | 0.080 |
| Ⅱ | 387 | 0.40 | ||
| Ⅲ | 207 | 0.20 | 0.090 | 0.090 |
| A、该反应的正方应为吸热反应 |
| B、达到平衡时,容器I中的CH3OH体积分数比容器Ⅱ中的小 |
| C、容器I中反应达到平衡所需时间比容器Ⅲ中的长 |
| D、若起始时向容器I中充入CH3OH 0.1mol、CH3OCH30.15mol和H2O 0.10mol,则反应将向正反应方向进行 |
| 0.080mol |
| 1.0L |
| 0.2mol-0.080mol×2 |
| 1.0L |
| 0.08×0.08 |
| 0.04×0.04 |
| 0.090mol |
| 1.0L |
| 0.2mol-0.00mol×2 |
| 1.0L |
| 0.09×0.09 |
| 0.02×0.02 |
| 0.1×0.15 |
| 0.1×0.1 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、用25mL的碱式滴定管量取20.0mL的KMnO4溶液 |
| B、制取NH3实验中,将多余的NH3用一导管直接导入水槽,用水吸收 |
| C、新制的氯水通常保存在棕色玻璃试剂瓶中 |
| D、氢氟酸可用石英器保存 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溴乙烷中滴入AgNO3溶液检验其中的溴元素:Br-+Ag+═AgBr↓ | ||||
| B、用醋酸除去水垢:CaCO3+2H+═Ca2++H2O+CO2↑ | ||||
C、葡萄糖与菲林试剂的反应:CH2OH(CHOH)4CHO+2Cu(OH)2+OH-
| ||||
D、苯酚钠溶液中通入少量CO2:CO2+H2O+ → → +HCO3- +HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验变量 实验序号 | 银氨溶液的量/mL | 乙醛的量/滴 | 温度/℃ | 反应混合液的pH | 出现银镜的时间/min |
| 1 | 1 | 3 | 65 | 11 | 5 |
| 2 | 1 | 3 | 45 | 11 | 6.5 |
| 3 | 1 | 5 | 65 | 11 | 4 |

查看答案和解析>>
科目:高中化学 来源: 题型:

| A、常压下五种元素的单质中Z单质的沸点最高 |
| B、Y、Z的阴离子电子层结构都与R原子的相同 |
| C、W的氢化物还原性小于Y的氢化物 |
| D、Y元素的非金属性比W元素的非金属性强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强(kPa) | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度(×10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
| 1 |
| 2 |
| T/℃ | t/min | |||
| pH=10.0 | pH=9.0 | pH=8.0 | pH=7.0 | |
| 15 | 30 | 24 | 16 | 6 |
| 20 | 18 | 13 | 8 | 4 |
| 25 | 12 | 8 | 3 | 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、同周期元素中X的金属性最强 |
| B、同周期元素中Y的最高价含氧酸的酸性最强 |
| C、原子半径X>Y,离子半径X+>Z2- |
| D、同族元素中Z的氢化物稳定性最高 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、7 | B、8 | C、9 | D、10 |
查看答案和解析>>
科目:高中化学 来源: 题型:
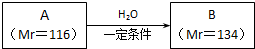
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com