

| A、常压下五种元素的单质中Z单质的沸点最高 |
| B、Y、Z的阴离子电子层结构都与R原子的相同 |
| C、W的氢化物还原性小于Y的氢化物 |
| D、Y元素的非金属性比W元素的非金属性强 |


科目:高中化学 来源: 题型:
| A、氯化铝溶液中加入过量的氨水:Al3++4NH3?H2O=AlO2-+4NH4++2H2O |
| B、大理石溶于醋酸的反应:CaCO3+2CH3COOH=Ca2++2CH3COO-+CO2↑+H2O |
| C、向次氯酸钙溶液中通入过量二氧化硫:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO |
| D、向碘化亚铁溶液中通入少量氯气:2Fe2++Cl2=2Fe3++2Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
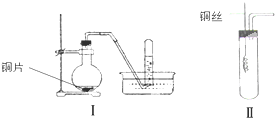 如图是铜与稀硝酸反应的两个实验装置图,请回答下列问题:
如图是铜与稀硝酸反应的两个实验装置图,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
 某学习小组为证明并观察铜与稀HNO3反应的产物是NO,设计了如图所示的实验装置.请你根据他们的思路,完成下述的实验报告.
某学习小组为证明并观察铜与稀HNO3反应的产物是NO,设计了如图所示的实验装置.请你根据他们的思路,完成下述的实验报告.查看答案和解析>>
科目:高中化学 来源: 题型:
| 容器 编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
| CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
| I | 387 | 0.20 | 0.080 | 0.080 |
| Ⅱ | 387 | 0.40 | ||
| Ⅲ | 207 | 0.20 | 0.090 | 0.090 |
| A、该反应的正方应为吸热反应 |
| B、达到平衡时,容器I中的CH3OH体积分数比容器Ⅱ中的小 |
| C、容器I中反应达到平衡所需时间比容器Ⅲ中的长 |
| D、若起始时向容器I中充入CH3OH 0.1mol、CH3OCH30.15mol和H2O 0.10mol,则反应将向正反应方向进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 2 |
| 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HClO、浓硫酸、HNO3均具有氧化性,都是氧化性酸 |
| B、H2O、HCOOH、Cu2(OH)2CO3均含有氧元素,都是氧化物 |
| C、HF、CH3COOH、CH3CH2OH都易溶于水,都是电解质 |
| D、HCOOH、H2CO3、H2SO4分子中均含有两个氢原子,都是二元酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com