
【题目】下列叙述及解释正确的是( )
A. 2NO2(g)(红棕色)![]() N2O4(g)(无色) ΔH<0,在平衡后,对平衡体系采取缩小容积、增大压强的措施,因为平衡向正反应方向移动,最终体系颜色比原平衡体系浅
N2O4(g)(无色) ΔH<0,在平衡后,对平衡体系采取缩小容积、增大压强的措施,因为平衡向正反应方向移动,最终体系颜色比原平衡体系浅
B. Cr2O72-(橙色)+ H2O![]() 2H++ 2CrO42-(黄色),在平衡后,滴加少量浓硫酸,因为平衡向逆反应方向移动,故体系颜色变为橙红色
2H++ 2CrO42-(黄色),在平衡后,滴加少量浓硫酸,因为平衡向逆反应方向移动,故体系颜色变为橙红色
C. FeCl3+3KSCN![]() Fe(SCN)3(红色)+3KCl,在平衡后,加入少量KCl固体,因为平衡向逆反应方向移动,故体系颜色变浅
Fe(SCN)3(红色)+3KCl,在平衡后,加入少量KCl固体,因为平衡向逆反应方向移动,故体系颜色变浅
D. 对于N2+3H2![]() 2NH3,平衡后,保持恒温恒容,充入He,平衡向逆反应方向移动
2NH3,平衡后,保持恒温恒容,充入He,平衡向逆反应方向移动
【答案】B
【解析】
A.缩小容积、增大压强平衡向气体体积减小的方向移动,但二氧化氮的浓度比压缩体积之前的浓度要大,所以体系颜色加深,故A错误;
B.Cr2O72-(橙色)+ H2O![]() 2H++ 2CrO42-(黄色),在平衡后,滴加少量浓硫酸,增大了溶液中的氢离子浓度,平衡向逆反应方向移动,故体系颜色变为橙红色,故B正确;
2H++ 2CrO42-(黄色),在平衡后,滴加少量浓硫酸,增大了溶液中的氢离子浓度,平衡向逆反应方向移动,故体系颜色变为橙红色,故B正确;
C.FeCl3+3KSCN![]() Fe(SCN)3(红色)+3KCl的离子反应方程式为:Fe3++3SCN-
Fe(SCN)3(红色)+3KCl的离子反应方程式为:Fe3++3SCN-![]() Fe(SCN)3(红色),改变氯离子或钾离子的浓度对平衡无影响,则加入少量KCl固体,平衡不移动,故C错误;
Fe(SCN)3(红色),改变氯离子或钾离子的浓度对平衡无影响,则加入少量KCl固体,平衡不移动,故C错误;
D. 对于N2+3H2![]() 2NH3,平衡后,保持恒温恒容,充入He,各反应混合物的浓度均不发生改变,所以平衡不移动,故D错误;
2NH3,平衡后,保持恒温恒容,充入He,各反应混合物的浓度均不发生改变,所以平衡不移动,故D错误;
答案选B。


 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:
【题目】镁在工业、医疗等领域均有重要用途。某化学兴趣小组利用硼砂工厂的固体废弃物(主要含有MgCO3、MgSiO3、Al2O3和Fe2O3等),设计了如下回收镁的工艺流程:

(1)酸浸前,将固体废弃物研磨的目的是___________________________________。为达到目的,还可以采取的措施是_________________________________________________(任写一条)。
(2)酸浸时,生成滤渣1的离子方程式为__________________________________。
(3)第一次调节pH的目的是_____________________________。当加入氨水使Al3+开始沉淀时,溶液中c(Fe3+)/c(Al3+)为__________________。已知:Ksp[Fe(OH)3]=4.0×10-38,Ksp[Al(OH)3]=1.0×10-33,Ksp[Mg(OH)2]=1.8×10-11。
(4)设计简单方案分离滤渣2中的成分,简述实验过程:________________________________。
(5)滤液3中可回收利用的物质主要是__________(写化学式),其阳离子的电子式为________。
(6)写出工业上从滤渣3中获得镁锭的所有反应的化学方程式:_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将0.1 mol/LNaOH溶液分别滴加到0.1 mol/LHA溶液和HB溶液中,两混合溶液中离子浓度与pH的变化关系如图所示,回答下列问题:

(1)请计算出Ka(HA) =_____,Ka(HB)_____ Ka(HA) (填“大于' “等于”或“小于”)。
(2)等浓度的HA和HB溶液,若要向其中之一加水让二者pH值相等,应该向_____中加水。
(3)若分别向等浓度等体积的HA和HB溶液中加入NaOH固体让二溶液都呈中性,则 ______需要的NaOH多。
(4)a点溶液中,水电离出的c(H+)=_______。b点溶液中,c(B-)____ c(Na+)(填“大于”、“等于”或“小于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中,能表示反应X(g)+2Y(g)![]() 2Z(g)一定达到化学平衡状态的是( )
2Z(g)一定达到化学平衡状态的是( )
① X、Y、Z的物质的量之比为1:2:2 ② X、Y、Z的浓度不再发生变化
③ X、Y、Z的浓度相等时 ④ 单位时间内消耗nmolX,同时生成2nmolZ
⑤ 2υ正(X)=υ逆(Y) ⑥ 容器中的压强不再发生变化
⑦ 密闭容器内气体的密度不再变化 ⑧ 密闭容器内气体的平均相对分子质量不再变化
A. ③⑤⑥⑦ B. ①③④⑦
C. ②④⑧ D. ②⑤⑥⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从能量的变化和反应的快慢等角度研究反应:![]() 。
。
(1)为了加快正反应速率,可以采取的措施有________(填序号)。
A.使用催化剂 B.适当提高氧气的浓度 C.适当提高反应的温度
(2)下图能正确表示该反应中能量变化的是________(填序号)。
A. 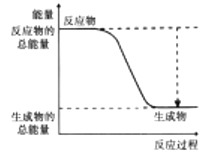 B.
B. 
(3)从断键和成键的角度分析上述反应中能量的变化。
化学键 | H—H | O=O | H—O |
键能 | 436 KJ·mol-1 | 496 KJ·mol-1 | 463 KJ·mol-1 |
请填写下表:_______________
化学键 | 填“吸收热量”或“放出热量” | 能量变化(KJ) |
拆开2molH2和1molO2中的化学键 | ①_________________ | ② KJ |
形成4molH-O键 | ③ | ④ KJ |
总能量变化 | ⑤ | ⑥ KJ |
(4)氢氧燃料电池的总反应方程式为![]() 。其中,氢气在________极发生________(“氧化”或“还原”)反应。
。其中,氢气在________极发生________(“氧化”或“还原”)反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置进行下列实验,能得出相应实验结论是( )
选项 | ① | ② | ③ | 实验结论 |
|
A | 稀硫酸 | Na2S | CuSO4溶液 | H2S酸性强于H2SO4 | |
B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 | |
C | 稀盐酸 | 亚硫酸钠 | 硝酸钡溶液 | 二氧化硫与可溶性钡盐均可生成白色沉淀 | |
D | 浓硝酸 | 碳酸钠 | 硅酸钠溶液 | 酸性:硝酸>碳酸>硅酸 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在2 L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示。

(1)当反应进行到第_______min,该反应达到平衡。
(2)计算X的转化率______。
(3)计算反应从开始至2分钟末,Z物质的化学反应速率______。
(4)由图中所给数据进行分析,该反应的化学方程式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为确定碳酸钠和碳酸氢钠混合样品中碳酸钠的质量分数,可通过加热分解得到的CO2质量进行计算,某同学设计的实验装置示意图如下:

请回答:
(1)仪器a的名称是_____________。
(2)装置B中冰水的作用是_________。
(3)该同学设计的实验装置存在缺陷,有关该实验装置及实验过程中,下列因素可能使碳酸钠的质量分数偏高的是______。
A.样品分解不完全
B.装置B、C之间缺少CO2的干燥装置
C.产生CO2气体的速率太快,没有被碱石灰完全吸收
D.反应完全后停止加热,通入过量的空气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com