
【题目】利用如图所示装置进行下列实验,能得出相应实验结论是( )
选项 | ① | ② | ③ | 实验结论 |
|
A | 稀硫酸 | Na2S | CuSO4溶液 | H2S酸性强于H2SO4 | |
B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 | |
C | 稀盐酸 | 亚硫酸钠 | 硝酸钡溶液 | 二氧化硫与可溶性钡盐均可生成白色沉淀 | |
D | 浓硝酸 | 碳酸钠 | 硅酸钠溶液 | 酸性:硝酸>碳酸>硅酸 |
A. A B. B C. C D. D
【答案】B
【解析】
A.H2S与CuSO4溶液反应生成硫化铜沉淀,根据溶液的成分判断硫化铜的性质;
B.浓硫酸使蔗糖变黑,然后碳与浓硫酸发生氧化还原反应生成二氧化硫,二氧化硫与溴水发生氧化还原反应使其褪色;
C.盐酸与亚硫酸钠生成二氧化硫,与Ba(NO3)2 溶液发生氧化还原反应生成硫酸钡沉淀;
D.浓硝酸与碳酸钠反应生成二氧化碳,但浓硝酸易挥发,硝酸、碳酸均可与硅酸钠溶液反应生成硅酸沉淀;
A.Na2S与稀硫酸反应生成硫化氢气体,H2S与CuSO4溶液反应生成硫化铜沉淀和硫酸,说明了硫化铜不溶于硫酸和水,不能说明H2S酸性强于H2SO4,故A错误;
B.浓硫酸具有脱水性使蔗糖变黑,然后碳与浓硫酸发生氧化还原反应生成二氧化硫,体现其强氧化性,最后二氧化硫与溴水发生氧化还原反应使其褪色,故B正确;
C.盐酸与亚硫酸钠生成二氧化硫,与Ba(NO3)2 溶液发生氧化还原反应生成硫酸钡沉淀,但SO2 与可溶性钡盐不一定生成白色沉淀,如与氯化钡不反应,故C错误;
D.浓硝酸与碳酸钠反应生成二氧化碳,但浓硝酸易挥发,硝酸、碳酸均可与硅酸钠溶液反应生成硅酸沉淀,则不能比较碳酸与硅酸的酸性,应排除硝酸的干扰,故D错误;
正确选项B。


科目:高中化学 来源: 题型:
【题目】乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业。实验室制取乙酸乙酯的主要步骤如下:
①在甲试管(如图)中加入2mL浓硫酸、3mL乙醇和2mL乙酸的混合溶液。
②按如图连接好装置(装置气密性良好)并加入混合液,小火均匀地加热3—5min。
③待试管乙收集到一定量产物后停止加热,撤出试管并用力振荡,然后静置待分层。
④分离出乙酸乙酯层、洗涤、干燥。
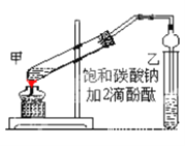
(1)若实验中用乙酸和含18O的乙醇作用,该反应的化学方程式是:________________________;与教材采用的实验装置不同,此装置中采用了球形干燥管,其作用是________________________。
(2)甲试管中,混合溶液的加入顺序:________________________;
(3)步骤②中需要用小火均匀加热,其主要原因是____________________________________;
(4)上述实验中饱和碳酸钠溶液的作用是____________(填字母代号)。
A. 反应掉乙酸和乙醇
B. 反应掉乙酸并吸收乙醇
C. 乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于分层析出
D. 加速酯的生成,提高其产率
(5)欲将乙试管中的物质分离开以得到乙酸乙酯,必须使用的仪器是____________;分离时,乙酸乙酯应该从仪器____________(填:“下口放”或“上口倒”)出。
(6)生成乙酸乙酯的反应是可逆反应,反应一段时间后,下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有____________(填序号)。
①混合物中各物质的浓度不再变化;
②单位时间里,生成1mol乙醇,同时生成1mol乙酸;
③单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸。
(7)为了证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用上图所示装置进行了以下4个实验。实验开始先用酒精灯微热3min,再加热使之微微沸腾3min。实验结束后充分振荡小试管Ⅱ再测有机层的厚度,实验记录如下:
实验编号 | 试管Ⅰ中试剂 | 试管Ⅱ中试剂 | 有机层的 厚度/cm |
A | 2mL乙醇、1mL乙酸、3mL 18mol·L1浓硫酸 | 饱和Na2CO3溶液 | 3. 0 |
B | 2mL乙醇、1mL乙酸、3mL H2O | 0. 1 | |
C | 2mL乙醇、1mL乙酸、3mL 2mol·L1 H2SO4 | 0. 6 | |
D | 2mL乙醇、1mL乙酸、盐酸 | 0. 6 |
①实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用。实验D中应加入盐酸的体积和浓度分别是_________mL和________mol·L1。
②分析实验_________(填实验编号)的数据,可以推测出浓H2SO4的吸水性提高了乙酸乙酯的产率。
(8)若现有乙酸90g,乙醇138g发生酯化反应得到88g乙酸乙酯,试计算该反应的产品产率为。___________(产率%=(实际产量/理论产量)×100%)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素 X、Y、Z、W 原子序数依次增大,X 是地壳中含量最多的元素,Y 原子的最外层只有一个电子,Z 位于元素周期表ⅢA族,W 与X属于同一主族。下列说法正确的是
A. 原子半径:r(W) > r(Z) > r(Y)
B. 由X、Y 组成的化合物中均不含共价键
C. Y 的最高价氧化物的水化物的碱性比Z的弱
D. X 的简单气态氢化物的热稳定性比W的强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含硫的物质与人们的生活密切相关。已知硫元素常见的化合价有-1、0、+4、+6四种,其不同价态的物质间可相互转化。完成下列填空:
(1)硫离子的结构示意图_____________。
(2)黑火药爆炸时,发生的反应之一为:S+2KNO3+3C![]() K2S+3CO2↑+N2↑该反应中1mol S能氧化C_______mol。
K2S+3CO2↑+N2↑该反应中1mol S能氧化C_______mol。
(3)将硫化氢气体与二氧化硫气体在集气瓶中混合发生反应,现象____________。二氧化硫呈现______________(选填“氧化性”、“还原性”)。
(4)二氧化硫是形成酸雨的“元凶”之一,由二氧化硫形成的酸雨的主要成分是硫酸。
以下是二氧化硫形成酸雨的两种途径:
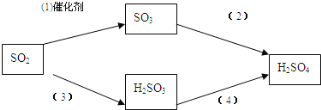
请分别写出(1)和(4)的化学方程式: ________________, ___________________。
(5)你认为减少酸雨产生的途径可采用的措施是_______________。
①少用煤作燃料 ②把工厂烟囱造高 ③燃料脱硫 ④在已酸化的土壤中加石灰 ⑤开发新能源
A. ①②③ B. ②③④ C. ①③⑤ D. ①③④⑤
(6)硫酸盐的种类很多,且应用广泛,医疗上常用_______(写化学式)作X射线透视肠胃的内服药剂,生活用水可以用_________(写化学式)作净水剂。
(7)有化学反应2SO2(g)+O2(g)![]() 2SO3(g) △H=-190kJ/mol,450℃往2L密闭容器中充入2mol SO2和1mol O2,5分钟后的SO2物质的量为0.5mol,则在5min内,用消耗的O2表示的反应速率为_____________________。在其它条件不变时,扩大容器体积,v(正)_______(选填“增大”或“减小”或“不变”),v(逆)______(选填“增大”或“减小”或“不变”)。
2SO3(g) △H=-190kJ/mol,450℃往2L密闭容器中充入2mol SO2和1mol O2,5分钟后的SO2物质的量为0.5mol,则在5min内,用消耗的O2表示的反应速率为_____________________。在其它条件不变时,扩大容器体积,v(正)_______(选填“增大”或“减小”或“不变”),v(逆)______(选填“增大”或“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能在有机物的分子中引入羟基的反应类型有( )
①酯化反应;②取代反应;③消去反应;④加成反应;⑤水解反应;⑥还原反应。
A.①②③④B.①②④⑤C.②④⑤⑥D.②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是核电荷数依次增大的五种短周期主族元素,A元素的原子核内只有1个质子,B元素的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层多4个;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C;C、E同主族.
(1)D在周期表中的位置______;B的原子结构示意图______;
(2)E元素形成最高价氧化物对应的水化物的化学式为______;
(3)元素C、D、E形成的原子半径大小关系是______(用元素符号表示).
(4)C、D可形成化合物D2C2,D2C2含有的化学键是______;
(5)A、C两种元素形成的原子个数之比为1:1的化合物电子式______,
(6)B的氢化物与B的最高价氧化物的水化物反应的离子方程式_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘在工农业生产和日常生活中有重要用途。

(1)上图为海带制碘的流程图。步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是_____________(从下列仪器中选出所需的仪器,用标号字母填写)。
A.烧杯B.坩埚C.表面皿D.泥三角E.酒精灯F.冷凝管
步骤④发生反应的离子方程式为____________________________________。
(2)若步骤⑤采用裂化汽油提取碘,后果是__________________________。
(3)溴化碘(IBr)的化学性质类似于卤素单质,如能与大多数金属反应生成金属卤化物,跟水反应的方程式为:IBr+H2O==HBr+HIO等,下列有关IBr的叙述中错误的是(____)。
A.固体溴化碘熔沸点较高
B.在许多反应中,溴化碘是强氧化剂
C.跟卤素单质相似,跟水反应时,溴化碘既是氧化剂,又是还原剂
D.溴化碘跟NaOH溶液反应生成NaBr、NaIO和H2O
(4)为实现中国消除碘缺乏病的目标。卫生部规定食盐必须加碘盐,其中的碘以碘酸钾(KIO3)存在。可以用硫酸酸化的碘化钾淀粉溶液检验加碘盐,下列说法正确的是(____)。
A.碘易溶于有机溶剂,可用酒精萃取碘水中的I2
B.检验加碘盐原理:IO3—+5I—+3H2O ===3I2+6OH—
C.在KIO3溶液中加入几滴淀粉溶液,溶液变蓝色
D.向某无色溶液中加入氯水和四氯化碳,振荡,静置,下层呈紫色,说明原溶液中有I—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 反应CO2(g)+C(s)![]() 2CO(g)的△H<0,△S>0
2CO(g)的△H<0,△S>0
B. 钢铁水闸可用牺牲阳极或者外加电流的阴极保护法减缓其腐蚀
C. 常温下,KSP[Al(OH)3]=1×10-33。欲使溶液中c(Al3+)≤1×10-6 mol·L-1,需调节溶液的pH≥5
D. 常温常压下,11.2 L Cl2与足量铁粉充分反应,转移电子数为6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用CH4催化还原NOx,可以消除氮氧化物的污染。例如:
①CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1
②CH4(g)+4NO(g)===2N2(g)+CO2(g)+2H2O(g) ΔH=-1 160 kJ·mol-1
下列说法不正确的是( )
A. 若用标准状况下4.48 L CH4还原NO2生成N2和水蒸气,放出的热量为173.4 kJ
B. 由反应①可推知:CH4(g)+4NO2(g)==4NO(g)+CO2(g)+2H2O(l) ΔH<-574 kJ·mol-1
C. 反应①②转移的电子数相同
D. 反应②中当4.48 L CH4反应完全时转移的电子总数为1.60 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com