
【题目】从能量的变化和反应的快慢等角度研究反应:![]() 。
。
(1)为了加快正反应速率,可以采取的措施有________(填序号)。
A.使用催化剂 B.适当提高氧气的浓度 C.适当提高反应的温度
(2)下图能正确表示该反应中能量变化的是________(填序号)。
A. 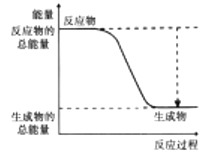 B.
B. 
(3)从断键和成键的角度分析上述反应中能量的变化。
化学键 | H—H | O=O | H—O |
键能 | 436 KJ·mol-1 | 496 KJ·mol-1 | 463 KJ·mol-1 |
请填写下表:_______________
化学键 | 填“吸收热量”或“放出热量” | 能量变化(KJ) |
拆开2molH2和1molO2中的化学键 | ①_________________ | ② KJ |
形成4molH-O键 | ③ | ④ KJ |
总能量变化 | ⑤ | ⑥ KJ |
(4)氢氧燃料电池的总反应方程式为![]() 。其中,氢气在________极发生________(“氧化”或“还原”)反应。
。其中,氢气在________极发生________(“氧化”或“还原”)反应。
【答案】ABC A
化学键 | 填“吸收”或“放出”能量 | 能量变化(kJ) | |
拆开化学键 | 2molH2中的化学键 | 吸收热量 | 1368 |
1molO2中的化学键 | |||
形成化学键 | 4molH-O键 | 放出热量 | 1852 |
总能量变化 | 放出热量 | 484 | |
负 氧化
【解析】
(1)为了加快![]() 的正反应速率:
的正反应速率:
A.使用催化剂,可以加快化学反应速率;
B.适当提高氧气的浓度,可以加快;
C.适当提高反应的温度,可以加快化学反应速率;
故可以采取的措施有ABC。
(2)该反应为放热反应,反应物的总能量高于生成物的总能量,故能正确表示该反应中能量变化的是A。
(3)H—H的键能为436 kJ·mol-1,O=O的键能496 kJ·mol-1,故破坏2molH2和1molO2的化学键共需吸收的热量为436kJ2+496 kJ= 1368 kJ;
H—O的键能为463 kJ·mol-1,故形成4molH-O键放出的热量为463 kJ4=1852kJ;
反应中的能量变化为放出热量1852kJ-1368 kJ=484kJ。
填表如下:
化学键 | 填“吸收”或“放出”能量 | 能量变化(kJ) | |
拆开化学键 | 2molH2中的化学键 | 吸收热量 | 1368 |
1molO2中的化学键 | |||
形成化学键 | 4molH-O键 | 放出热量 | 1852 |
总能量变化 | 放出热量 | 484 | |
(4)氢氧燃料电池的总反应方程式为![]() 。其中,氢气是还原剂,其在负极发生氧化反应。
。其中,氢气是还原剂,其在负极发生氧化反应。


科目:高中化学 来源: 题型:
【题目】某兴趣小组根据镁与沸水的反应推测镁也能与饱和碳酸氢钠溶液反应。资料显示:镁与饱和碳酸氢钠溶液反应产生大量气体和白色不溶物。该兴趣小组设计了如下实验方案并验证产物、探究反应原理。
实验Ⅰ:用砂纸擦去镁条表面氧化膜,将其放入盛有适量滴有酚酞的饱和碳酸氢钠溶液的试管中,迅速反应,产生大量气泡和白色不溶物,溶液由浅红变红。
(1)提出假设
该同学对反应中产生的白色不溶物作出如下猜测:
猜测1:可能是____________________。
猜测2:可能是MgCO3。
猜测3:可能是碱式碳酸镁[xMgCO3·yMg(OH)2]。
(2)设计定性实验确定产物并验证猜测:
实验序号 | 实验 | 预期现象和结论 |
实验Ⅱ | 将实验Ⅰ中收集的气体点燃 | ______________________________________ |
实验Ⅲ | 取实验Ⅰ中的白色不溶物,洗涤,加入足量________ | 如果出现______________,则白色不溶物可能是MgCO3 |
实验Ⅳ | 取实验Ⅰ中的澄清液,向其中加入少量CaCl2稀溶液 | 如果产生白色沉淀,则溶液中存在______离子 |
(3)设计定量实验确定实验Ⅰ的产物:称取实验Ⅰ中所得干燥、纯净的白色不溶物31.0 g,充分加热至不再产生气体为止,并使分解产生的气体全部进入装置A和B中。实验前后装置A增重1.8 g,装置B增重13.2 g,试确定白色不溶物的化学式________________________。

(4)请结合化学用语和化学平衡移动原理解释Mg和饱和NaHCO3溶液反应产生大量气泡的原因__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气净化中的一个反应如下:NO(g)+CO(g)![]() 1/2N2(g)+CO2(g) ΔH=-373.4 kJ·mol-1,在恒容的密闭容器中,反应达到平衡后,改变某一条件,下列示意图正确的是
1/2N2(g)+CO2(g) ΔH=-373.4 kJ·mol-1,在恒容的密闭容器中,反应达到平衡后,改变某一条件,下列示意图正确的是
A.  B.
B.  C.
C.  D.
D. 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图是锌片和铜片同时插入稀硫酸中所组成的原电池装置,c、d为两个电极。则下列有关的判断不正确的是( )

A、d为负极,发生氧化反应
B、c为锌片,电池工作时,溶液中SO42-向c移动
C、电池工作的过程中,d电极上产生大量的气泡
D、电池工作的过程中,溶液中SO42-浓度基本不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,可逆反应N2+3H2![]() 2NH3 △H<0达到平衡后,只改变一个条件,下列叙述错误的是
2NH3 △H<0达到平衡后,只改变一个条件,下列叙述错误的是
A. 加催化剂,v正、v逆都发生变化,且变化的倍数相等
B. 加压,v正、v逆都增大,且v正增大的倍数大于v逆增大的倍数
C. 增大氮气的浓度,N2的平衡转化率减小,H2的平衡转化率增大
D. 降温,v正、v逆都减小,且v正减小的倍数大于v逆减小的倍数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述及解释正确的是( )
A. 2NO2(g)(红棕色)![]() N2O4(g)(无色) ΔH<0,在平衡后,对平衡体系采取缩小容积、增大压强的措施,因为平衡向正反应方向移动,最终体系颜色比原平衡体系浅
N2O4(g)(无色) ΔH<0,在平衡后,对平衡体系采取缩小容积、增大压强的措施,因为平衡向正反应方向移动,最终体系颜色比原平衡体系浅
B. Cr2O72-(橙色)+ H2O![]() 2H++ 2CrO42-(黄色),在平衡后,滴加少量浓硫酸,因为平衡向逆反应方向移动,故体系颜色变为橙红色
2H++ 2CrO42-(黄色),在平衡后,滴加少量浓硫酸,因为平衡向逆反应方向移动,故体系颜色变为橙红色
C. FeCl3+3KSCN![]() Fe(SCN)3(红色)+3KCl,在平衡后,加入少量KCl固体,因为平衡向逆反应方向移动,故体系颜色变浅
Fe(SCN)3(红色)+3KCl,在平衡后,加入少量KCl固体,因为平衡向逆反应方向移动,故体系颜色变浅
D. 对于N2+3H2![]() 2NH3,平衡后,保持恒温恒容,充入He,平衡向逆反应方向移动
2NH3,平衡后,保持恒温恒容,充入He,平衡向逆反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下图银锌原电池中,以硫酸铜为电解质溶液。

(1)锌为______极,该电极上发生的是_____________反应(“氧化”或“还原”),电极反应式为__________________________________。
(2)银为____极,电极上发生的是_______反应(“氧化”或“还原”),电极反应式是__________________,银片上观察到的现象是__________________________。
(3)该原电池的总反应式是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或表示方法正确的是
A.等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出热量多
B.由C(石墨,s)=C(金刚石,s) △H=+1.9kJ/mol可知,金刚石比石墨稳定
C.在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l) △H=﹣285.8kJ/mol
D.在稀溶液中,H+(aq)+OH﹣(aq)=H2O(l) △H=﹣57.3kJ/mol,若将含0.5molH2SO4的浓硫酸与含1molKOH的溶液混合,放出的热量大于57.3kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A.常温下,浓硫酸不与铜反应,是因为铜被钝化
B.可用铁罐来进行储存、运输冷的浓硫酸
C.SO3具有氧化性,SO2只有还原性
D.SO2、Cl2的漂白原理相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com