
【题目】芳香酯类化合物A、B互为同分异构体,均含C、H、O三种元素。相同状况下,A、B蒸气对氢气的相对密度是97,分子中C、H原子个数相同,且C、H原子个数之和是氧原子数的5倍。已知:各有机物间存在如下转化关系:
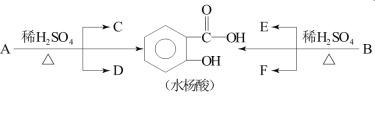
其中C能发生银镜反应,F经连续氧化可生成C;C与D是相对分子质量相同的不同类有机物。
(1)A的分子式是________。
(2)E中所含官能团的名称是________;完全燃烧时,1 mol D与1 mol下列________的耗氧量相同(填字母代号)。
a.C3H6O3 b.C3H8O c.C2H4 d.C2H6O2
(3)写出水杨酸与小苏打反应的化学方程式是___________;写出C与F反应的化学方程式是_________。
(4)同时符合下列要求的同分异构体有___________种。
①与A互为同分异构体;
②能发生水解反应;
③苯环上有两个取代基,且苯环上的一氯代物只有1种。
(5)1 mol 上述(4)中的一种有机物X,能与4 mol NaOH发生反应,写出此反应的化学方程式__________
【答案】C10H10O4 羧基 ac 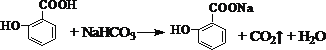 CH3OH+HCOOH
CH3OH+HCOOH ![]() HCOOCH3+H2O 3
HCOOCH3+H2O 3 ![]() +4NaOH
+4NaOH![]() 2CH3COONa+
2CH3COONa+![]() +2H2O
+2H2O
【解析】
A、B蒸气对氢气的相对密度是97,则相对分子质量为194,分子中C、H原子个数相同,且C、H原子总数是氧原子数的5倍,设C原子数为n,则H原子数为n,O原子数为![]() ,则12n+n+
,则12n+n+![]() ×16=194,n=10,分子式为C10H10O4,C能发生银镜反应,应含有醛基,F经连续氧化可生成C,说明F为醇,C为酸且含有醛基,应为HCOOH,则F为CH3OH;C与D是相对分子质量相同的不同类有机物,则D应为CH3CH2OH,由此可知A为
×16=194,n=10,分子式为C10H10O4,C能发生银镜反应,应含有醛基,F经连续氧化可生成C,说明F为醇,C为酸且含有醛基,应为HCOOH,则F为CH3OH;C与D是相对分子质量相同的不同类有机物,则D应为CH3CH2OH,由此可知A为![]() ,E为CH3COOH,B为
,E为CH3COOH,B为![]() ,据此分析。
,据此分析。
A、B蒸气对氢气的相对密度是97,则相对分子质量为194,分子中C、H原子个数相同,且C、H原子总数是氧原子数的5倍,设C原子数为n,则H原子数为n,O原子数为![]() ,则12n+n+
,则12n+n+![]() ×16=194,n=10,分子式为C10H10O4,C能发生银镜反应,应含有醛基,F经连续氧化可生成C,说明F为醇,C为酸且含有醛基,应为HCOOH,则F为CH3OH;C与D是相对分子质量相同的不同类有机物,则D应为CH3CH2OH,由此可知A为
×16=194,n=10,分子式为C10H10O4,C能发生银镜反应,应含有醛基,F经连续氧化可生成C,说明F为醇,C为酸且含有醛基,应为HCOOH,则F为CH3OH;C与D是相对分子质量相同的不同类有机物,则D应为CH3CH2OH,由此可知A为![]() ,E为CH3COOH,B为
,E为CH3COOH,B为![]() 。
。
(1)由以上分析可知A的分子式为C10H10O4;
(2)E为CH3COOH,所含官能团的名称是羧基;
D为CH3CH2OH,1molCH3CH2OH完全燃烧消耗(2+![]() -
-![]() )mol=3mol氧气,
)mol=3mol氧气,
a消耗氧气为3+![]() -
-![]() =3mol,b消耗氧气为3+
=3mol,b消耗氧气为3+![]() -
-![]() =4.5mol,c消耗氧气为2+
=4.5mol,c消耗氧气为2+![]() =3mol,d消耗氧气为2+
=3mol,d消耗氧气为2+![]() -
-![]() =2.5mol,
=2.5mol,
答案选ac;
(3)水杨酸含有-COOH,可与碳酸氢钠反应,但酚羟基不反应,则反应的方程式为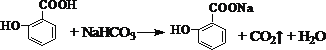 ;
;
C为HCOOH,F为CH3OH,二者可发生酯化反应,反应的方程式为CH3OH+HCOOH ![]() HCOOCH3+H2O;
HCOOCH3+H2O;
(4)A为![]() ,对应的同分异构体能水解,说明含有酯基,苯环上有两个取代基,且苯环上的一氯代物只有1种,说明取代基相同,且位于对位,可能的同分异构体有
,对应的同分异构体能水解,说明含有酯基,苯环上有两个取代基,且苯环上的一氯代物只有1种,说明取代基相同,且位于对位,可能的同分异构体有![]() 、
、![]() 、
、![]() 共3种;
共3种;
(5)1 mol 上述(4)中的一种有机物X,能与4 mol NaOH发生反应,则X为![]() ,此反应的化学方程式为
,此反应的化学方程式为![]() +4NaOH
+4NaOH![]() 2CH3COONa+
2CH3COONa+![]() +2H2O。
+2H2O。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列有关叙述正确的是
A.标准状况下,22.4 L CH2Cl2中含有碳原子数为NA
B.在溶有1molFe(OH)3的胶体中含有的胶粒数小于NA
C.常温下0.2 mol铝与足量浓硫酸反应,生成气体的分子数为0.3 NA
D.常温下向密闭容器内充入46 g NO2,容器中气体的分子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在![]() 时,碳酸钙在水中的沉淀溶解平衡曲线如图所示,已知
时,碳酸钙在水中的沉淀溶解平衡曲线如图所示,已知![]() 时硫酸钙的Ksp=9.1×10-6,下列说法正确的是( )
时硫酸钙的Ksp=9.1×10-6,下列说法正确的是( )
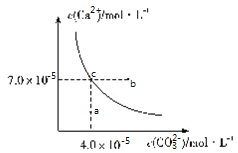
A.除去锅炉水垢中硫酸钙的办法是将其转化为碳酸钙,然后用酸去除
B.图中b点碳酸钙的结晶速率小于其溶解速率
C.通过蒸发,可使溶液由a点变化到c点
D.在25℃时,反应![]() 的平衡常数K=3500
的平衡常数K=3500
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溶液中的化学反应大多是离子反应。根据要求回答下列问题:
(1)盐碱地(含较多Na2CO3、NaCl)不利于植物生长,试用化学方程式表示:盐碱地产生碱性的原因:______________;农业上用石膏降低其碱性的反应原理:__________。
(2)若取pH、体积均相等的NaOH溶液和氨水分别用水稀释m倍、n倍,稀释后pH仍相等,则m________(填“>”“<”或“=”)n。
(3)常温下,在pH=6的CH3COOH与CH3COONa的混合溶液中水电离出来的c(OH-)=__________。
(4)25 ℃时,将a mol·L-1氨水与0.01 mol·L-1盐酸等体积混合,反应平衡时溶液中c(![]() )=c(Cl-),则溶液显________(填“酸”“碱”或“中”)性。用含a的代数式表示NH3·H2O的电离常数Kb=________。
)=c(Cl-),则溶液显________(填“酸”“碱”或“中”)性。用含a的代数式表示NH3·H2O的电离常数Kb=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】表是25℃时某些盐的溶度积常数和弱酸的电离平衡常数,下列说法正确的是
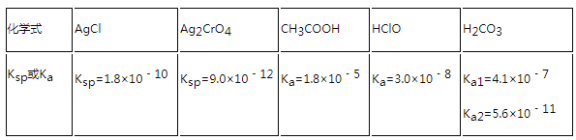
A.相同浓度CH3COONa和NaClO的混合溶液中,各种离子浓度的大小关系是:c(Na+)>c(ClO﹣)>c(CH3COO﹣)>c(OH﹣)>c(H+)
B.次氯酸钠溶液中通入少量CO2的离子方程式为:2ClO﹣+CO2+H2O=CO32﹣+2HClO
C.向0.1 molL﹣1CH3COOH溶液中滴加NaOH溶液中至c(CH3COOH):c(CH3COO﹣)=5:9,此时溶液的pH=5
D.向浓度均为1.0×10﹣3molL﹣1的KCl和K2CrO4混合溶液中滴加1.0×10﹣3molL﹣1的AgNO3溶液,CrO42﹣先形成沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在室温下,下列五种溶液:①0.1mol/L NH4Cl②0.1mol/L CH3COONH4 ③0.1mol/LNH4HSO4④0.1mol/L NH3H2O和0.1mol/L NH4Cl混合液 ⑤0.1mol/L NH3H2O。
请根据要求填写下列空白:
(1)溶液①呈_____性(填“酸”、“碱”或“中”),其原因是________(用离子方程式表示)。
(2)比较②③溶液中,c(NH4+)的大小关系是②______③(填“>”“<”或“=”)。
(3)在溶液④中,_____ 离子的浓度为0.1mol/L;NH3H2O和_____离子的物质的量浓度之和为0.2mol/L。
(4)室温下,测得溶液②的pH=7,则CH3COO-的水解程度_____(填“>”“<”或“=”)NH4+-的水解程度。CH3COO-与NH4+浓度的大小关系是:c(CH3COO-)_____c(NH4+)(填“>”“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
①常温下,强酸溶液的pH=a,将溶液的体积稀释到原来10n倍,则pH=a+n;
②已知BaSO4的Ksp=c(Ba2+)c(SO42﹣),所以在BaSO4溶液中有c(Ba2+)=c(SO42﹣)=![]()
③将0.1molL﹣1的NaHS和0.1molL﹣1Na2S溶液等体积混合,所得溶液中有c(S2﹣)+2c(OH﹣)=2c(H+)+c(HS﹣)+3c(H2S)
④在0.1mol/L氨水中滴加0.1mol/L盐酸,刚好完全中和时pH=a,则由水电离产生的c(H+)=10﹣a molL﹣1
A.①④B.②③C.③④D.①②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应(均未配平)中,氧化剂与还原剂物质的量的关系为1∶2的是
A.Cu+H2SO4![]() CuSO4+SO2↑+H2O
CuSO4+SO2↑+H2O
B.CH3COOH+Ca(ClO)2![]() HClO+Ca(CH3COO)2
HClO+Ca(CH3COO)2
C.I2+NaClO3![]() NaIO3+Cl2
NaIO3+Cl2
D.HCl+MnO2![]() MnCl2+Cl2↑+H2O
MnCl2+Cl2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活相互渗透,下列说法中不正确的是![]()
A.臭氧![]() 生物活性炭用于自来水深度处理,利用了臭氧的强氧化性和活性炭的吸附性。
生物活性炭用于自来水深度处理,利用了臭氧的强氧化性和活性炭的吸附性。
B.华为自主研发的“麒麟”芯片与光导纤维是同种材料。
C.采取“静电除尘”、“燃煤烟气脱硫”、“汽车尾气催化净化”等方法可提高空气质量。
D.![]() 天工开物
天工开物![]() 记载:“凡埏泥造瓦,掘地二尺余,择取无沙黏土而为之。”“瓦”是传统无机非金属材料,主要成分为硅酸盐。
记载:“凡埏泥造瓦,掘地二尺余,择取无沙黏土而为之。”“瓦”是传统无机非金属材料,主要成分为硅酸盐。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com