
【题目】抗心律失常药物心律平的合成路线如下:

已知:① R-OH + Cl-R![]() R-O-R + HCl
R-O-R + HCl
②R-CHO+![]()
![]()
![]() + H2O
+ H2O
请回答:
(1)A属于链烃,则A中所含的官能团是______。
(2)B中无甲基,A→B的反应类型是______反应。
(3)C的结构简式是______。
(4)E中含有三元环,且无羟基,则D→E的化学方程式是______。
(5)结合官能团的性质,解释F→G的转化中需酸化的原因:______。
(6)H的结构简式是______。
(7)I→J的化学方程式是______。
(8)在I→J的反应中,生成J的同时会有副产物K,K与J互为同分异构体,则K的结构简式是______。
【答案】碳碳双键(或![]() C=C
C=C![]() ) 取代 CH2 = CHCH2OH
) 取代 CH2 = CHCH2OH 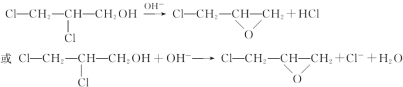 F中的酚羟基具有弱酸性,在碱性条件下成盐,最终用酸将酚羟基复原
F中的酚羟基具有弱酸性,在碱性条件下成盐,最终用酸将酚羟基复原 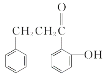
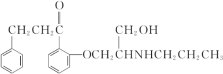
【解析】
由A的分子式为C3H6,又属于链烃,所以A结构简式为CH2=CHCH3,由![]() ,且B中无甲基知B的结构简式为CH2=CHCH2Cl,根据框图和相应的反应条件可知C的结构简式CH2 = CHCH2OH,D的结构简式CH2ClCHClCH2OH。根据已知R-OH + Cl-R
,且B中无甲基知B的结构简式为CH2=CHCH2Cl,根据框图和相应的反应条件可知C的结构简式CH2 = CHCH2OH,D的结构简式CH2ClCHClCH2OH。根据已知R-OH + Cl-R![]() R-O-R + HCl知E的结构简式
R-O-R + HCl知E的结构简式![]() ;由已知②R-CHO+
;由已知②R-CHO+![]()
![]()
![]() + H2O和框图
+ H2O和框图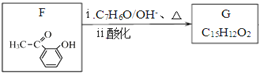 知G的结构简式为
知G的结构简式为![]() ,H的结构简式为
,H的结构简式为![]() ,I的结构简式为为
,I的结构简式为为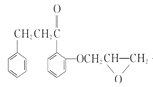 ,J的结构简式为
,J的结构简式为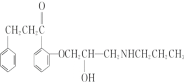 。
。
(1)由A的分子式为C3H6,又属于链烃,所以A中所含的官能团是碳碳双键(或![]() C=C
C=C![]() )。答案:碳碳双键(或
)。答案:碳碳双键(或![]() C=C
C=C![]() )。
)。
(2)由![]() ,且B中无甲基知B的结构简式为CH2=CHCH2Cl,知A→B发生了取代反应。答案:取代。
,且B中无甲基知B的结构简式为CH2=CHCH2Cl,知A→B发生了取代反应。答案:取代。
(3)由![]() 知C发生了卤代烃的取代反应,所以C的结构简式是CH2 = CHCH2OH。答案:CH2 = CHCH2OH。
知C发生了卤代烃的取代反应,所以C的结构简式是CH2 = CHCH2OH。答案:CH2 = CHCH2OH。
(4)由D的结构简式为CH2ClCHClCH2OH,由E中含有三元环,且无羟基,则E的结构简式为![]() ,D→E的化学方程式是:
,D→E的化学方程式是: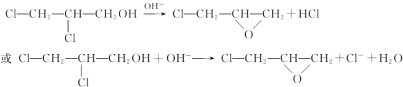 。
。
(5)F的结构简式为![]() ,酚羟基具有弱酸性,而F→G的反应条件是碱性环境,会生成盐,所以需要加酸将酚羟基复原。答案:F中的酚羟基具有弱酸性,在碱性条件下成盐,最终用酸将酚羟基复原 。
,酚羟基具有弱酸性,而F→G的反应条件是碱性环境,会生成盐,所以需要加酸将酚羟基复原。答案:F中的酚羟基具有弱酸性,在碱性条件下成盐,最终用酸将酚羟基复原 。
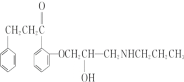
(6)由上述分析可知H的结构简式是: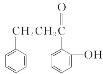 。
。
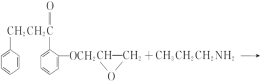
(7)由I为 ,J为
,J为 ,I→J化学方程式是
,I→J化学方程式是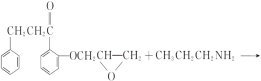

(8)根据成键特点知在I→J的反应中,生成( )或(
)或( ),K与J互为同分异构体,所以K的结构简式是
),K与J互为同分异构体,所以K的结构简式是 。
。


科目:高中化学 来源: 题型:
【题目】某研究小组设计如下所示实验装置(夹持装置已略去)分别探究NO与铜粉、Na2O2的反应。

已知:①NO与Na2O2可发生反应2NO+Na2O2===2NaNO2。
②NO能被酸性高锰酸钾溶液氧化为NO3-
③在溶液中存在平衡FeSO4+NO![]() Fe(NO)SO4(棕色)
Fe(NO)SO4(棕色)
I.关闭K3,打开K2,探究NO与铜粉的反应并检验NO。
(1)反应开始前,打开K1,通入一段时间N2,其目的是______________________。
(2)装置B中盛放的试剂为水,其作用是______________________。
(3)装置F中的实验现象为___________。装置H中收集的气体为___________(填化学式)。
Ⅱ.关闭K2,打开K3,探究NO与Na2O2的反应并制备NaNO2。
(4)装置G的作用是______________________。
(5)若省略装置C,则进入装置G中的气体除N2、NO外,可能还有___________(填化学式)。
(6)测定反应后装置E中NaNO2的含量。已知;在酸性条件下,NO2-可将MnO4-还原为Mn2+,为测定样品中亚硝酸钠的含量,该小组同学称取ag样品溶于水配制成250mL溶液,取25.00mL所得溶液于锥形瓶中,用0.100mol·L-1的酸性KMnO4溶液滴定至终点时,消耗bmL酸性KMnO4溶液。
①滴定过程中发生反应的离子方程式为______________________。
②滴定过程中酸性KMnO4溶液的作用是___________。
③样品中NaNO2的质量分数为___________用含有a、b的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】类比pH的定义,对于稀溶液可以定义pC=-lgC,pKa=-lgKa。常温下,某浓度H2A溶液中滴加NaOH溶液,测得pC(H2A)、pC(HA-)、pC(A2-)变化如图所示。下列说法正确的是()

A. pH=3.50时,c(H2A)>c(HA-)>c(A2-)
B. 从a点开始滴入NaOH溶液,溶液中c(H+)/c(H2A)先减小后增大
C. 将等浓度等体积的Na2A与H2A溶液混合后,溶液显碱性
D. pH从3.00到5.30时,c(H2A)+c(HA-)+c(A2-)先增大后减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种突破传统电池设计理念的镁-锑液态金属储能电池的工作原理如图所示,该电池所用液体密度不同,在重力作用下分三层,工作时中间层熔融盐的组成及浓度不变。下列说法不正确的是( )

A. 放电时,Mg(液)层的质量减小
B. 放电时正极反应为Mg2++2e-=Mg
C. 该电池充电时,Mg-Sb(液)层发生还原反应
D. 该电池充电时,Cl-向中下层界面处移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高炉炼铁过程中发生反应:![]() Fe2O3(s)+CO(g)
Fe2O3(s)+CO(g) ![]()
![]() Fe(s)+CO2(g),该反应在不同温度下的平衡常数见表。
Fe(s)+CO2(g),该反应在不同温度下的平衡常数见表。
温度T/℃ | 1000 | 1150 | 1300 |
平衡常数K | 4.0 | 3.7 | 3.5 |
下列说法正确的是
A. 增加高炉的高度可以有效降低炼铁尾气中CO的含量
B. 由表中数据可判断该反应:反应物的总能量>生成物的总能量
C. 为了使该反应的K增大,可以在其他条件不变时,增大c(CO)
D. 1000℃下Fe2O3与CO反应,t min达到平衡时c(CO) =2×10-3 mol/L,则用CO表示该反应的平均速率为![]() mol/(L·min)
mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁、戊、己六种有机物的化学式如下表所示:
物质 | 甲 | 乙 | 丙 | 丁 | 戊 | 己 |
化学式 | CH4 | C2H4 | C3H8 | C4H8 | C2H6O | C2H4O2 |
下列与这些有机物有关的说法不正确的是
A. 甲、丙均不能使酸性高锰酸钾溶液褪色B. 丁的结构可能有5种(不考虑立体异构)
C. 等质量的乙、戊完全燃烧时耗氧量相等D. 己可能发生银镜反应而不发生水解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸工业和合成氨工业是衡量一个国家工业发展水平的重要指标,下图是硫酸工业和合成氨工业联合生产示意图:

回答下列问题:
(1)已知:
4Fe(s)+3O2(g)=2Fe2O3(s) △H=akJ/mol
SO2 (g)=S(s)+O2(g)△H=bkJ/mol
Fe(s)+2S(s)=Fe2S(s)△H=ckJ/mol
沸腾炉中主要反应的热化学方程式为____。
(2)如果生产过程中H2的总转化率为90%,FeS2的总转化率为95%,氨与硫酸生成硫酸铵的转化率为100%,则最初FeS2和H2的物质的量之比为 ___。
(3)在一定条件下,分别向体积相同的恒容密闭容器甲,乙、丙中通入一定量的N2、H2或 NH3,发生反应:N2 (g)+3H2=2NH3 (g),相关数据如下:

①乙中NH3的转化率为 ___,丙中x的取值范围为 ___。
②在t1时升高甲容器的温度,至t2时再次达到平衡,测得t2时 混合气体的平均摩尔质量比tl时小。请在图中画出tl~t2 时间段正反应速率的变化示意图______________。

(4)尾气中含有SO2,直接排放会造成环境污染,可用Fe2(SO4)3 溶液吸收。某科研团队对pH、c(Fe3+)、温度等因素对SO2最 高吸收率的影响进行研究,结果如图:

40℃时SO2的最高吸收率随pH、c(Fe3+)的增大而 __,其原因是 ___;温度高于 40℃后,SO2的最高吸收率随温度的升高而减小,其原因是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】臭氧层是地球生命的保护神,其中的臭氧(O3)和氧气(O2)是氧元素的两种单质。
(1)含有相同氧原子数的臭氧和氧气的物质的量之比为__________。
(2)同温同压时,相等质量的臭氧和氧气的密度之比为________,所占有的体积之比为__________,所含有的原子个数之比为_________。
(3)已知反应:O3 + 2KI + H2O = 2KOH + I2 + O2 。标准状况下的2.24L臭氧完全反应,生成的KOH的质量为_____克。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】了解并理解物质的内部结构以及化学键和晶体类型可以帮助我们更好地了解物质世界。已知:实验室用![]() 制氯化氢,溶于水形成盐酸。
制氯化氢,溶于水形成盐酸。
(1)写出原子的结构示意图Na_______,Cl______。
(2)NaCl电子式为___,所含化学键名称_____,属于______晶体;HCl电子式为____,所含化学键名称____,属于______晶体。
(3)氯化氢溶于水形成盐酸的电离方程式______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com