
【题目】硫酸工业和合成氨工业是衡量一个国家工业发展水平的重要指标,下图是硫酸工业和合成氨工业联合生产示意图:

回答下列问题:
(1)已知:
4Fe(s)+3O2(g)=2Fe2O3(s) △H=akJ/mol
SO2 (g)=S(s)+O2(g)△H=bkJ/mol
Fe(s)+2S(s)=Fe2S(s)△H=ckJ/mol
沸腾炉中主要反应的热化学方程式为____。
(2)如果生产过程中H2的总转化率为90%,FeS2的总转化率为95%,氨与硫酸生成硫酸铵的转化率为100%,则最初FeS2和H2的物质的量之比为 ___。
(3)在一定条件下,分别向体积相同的恒容密闭容器甲,乙、丙中通入一定量的N2、H2或 NH3,发生反应:N2 (g)+3H2=2NH3 (g),相关数据如下:

①乙中NH3的转化率为 ___,丙中x的取值范围为 ___。
②在t1时升高甲容器的温度,至t2时再次达到平衡,测得t2时 混合气体的平均摩尔质量比tl时小。请在图中画出tl~t2 时间段正反应速率的变化示意图______________。

(4)尾气中含有SO2,直接排放会造成环境污染,可用Fe2(SO4)3 溶液吸收。某科研团队对pH、c(Fe3+)、温度等因素对SO2最 高吸收率的影响进行研究,结果如图:

40℃时SO2的最高吸收率随pH、c(Fe3+)的增大而 __,其原因是 ___;温度高于 40℃后,SO2的最高吸收率随温度的升高而减小,其原因是____。
【答案】4FeS2(s)+11O2(g)=2Fe2O3(s)+8SO2(g) △H=(a-8b-4c)kJ·mol-1 3:19 60% 1.6<x<4 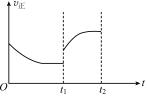 增大 吸收过程中,发生2Fe3++SO2+2H2O
增大 吸收过程中,发生2Fe3++SO2+2H2O![]() 2Fe2++SO42-+4H+,c(Fe3+)、pH增大,平衡向正反应方向移动 温度升高,Fe3+水解程度越大,c(Fe3+)减小、c(H+)增大,平衡2Fe3++SO2+2H2O
2Fe2++SO42-+4H+,c(Fe3+)、pH增大,平衡向正反应方向移动 温度升高,Fe3+水解程度越大,c(Fe3+)减小、c(H+)增大,平衡2Fe3++SO2+2H2O![]() 2Fe2++SO42-+4H+向逆反应方向移动,SO2的最高吸收率减小
2Fe2++SO42-+4H+向逆反应方向移动,SO2的最高吸收率减小
【解析】
(1)①4Fe(s)+3O2(g)=2Fe2O3(s) ,②SO2 (g)=S(s)+O2(g),③Fe(s)+2S(s)=Fe2S(s),沸腾炉中发生的反应式4FeS2+11O2=2Fe2O3+8SO2,①-8×②-④×③,△H=(a-8b-4c)kJ·mol-1,其热化学反应方程式为4FeS2(s)+11O2(g)=2Fe2O3(s)+8SO2(g) △H=(a-8b-4c)kJ·mol-1;
(2)合成氨N2+3H2![]() 2NH3,产生NH3的物质的量为2×n(H2)×90%/3mol,制备硫酸建立的关系是FeS2~2SO2~2SO3~2H2SO4,产生硫酸的物质的量为2×n(FeS2)×95%mol,制备硫酸铵的反应方程式为2NH3+H2SO4=(NH4)2SO4,因为得到硫酸铵是转化率为100%,因此有2×n(H2)×90%/3mol:2×n(FeS2)×95%mol=2:1,n(FeS2):n(H2)=3:19;
2NH3,产生NH3的物质的量为2×n(H2)×90%/3mol,制备硫酸建立的关系是FeS2~2SO2~2SO3~2H2SO4,产生硫酸的物质的量为2×n(FeS2)×95%mol,制备硫酸铵的反应方程式为2NH3+H2SO4=(NH4)2SO4,因为得到硫酸铵是转化率为100%,因此有2×n(H2)×90%/3mol:2×n(FeS2)×95%mol=2:1,n(FeS2):n(H2)=3:19;
(3)①在温度、体积一定的条件下,甲、乙两容器中形成等效平衡,因此α(N2)甲+α(NH3)乙=1,α(N2)甲=0.8mol/(2×1)×100%=40%,则α(NH3)乙=60%;丙容器相当于将两个甲容器加压缩小为一个甲容器,加压时,该平衡向正反应方向移动,因此丙中x的范围是1.6<n(NH3)<4;
②t1时升高温度,v正增大,升高温度,平均摩尔质量减小,说明该平衡向逆反应方向移动,N2、H2浓度增大,因此t1-t2时间段v正持续增大,图像为 ;
;
(4)由图可知,随着c(Fe3+)、pH的增大,SO2的最高吸收率增大;Fe3+具有强氧化性,能将SO2氧化成SO42-,离子方程式为2Fe3++SO2+2H2O![]() 2Fe2++SO42-+4H+,c(Fe3+)、pH增大,平衡向正反应方向移动;由温度关系图可知,在40℃时,SO2的最高吸收率最大,温度高于40℃后,温度升高,SO2的最高吸收率减小,只能是有关物质浓度改变所致,温度升高,Fe3+水解程度越大,c(Fe3+)减小、c(H+)增大,平衡2Fe3++SO2+2H2O
2Fe2++SO42-+4H+,c(Fe3+)、pH增大,平衡向正反应方向移动;由温度关系图可知,在40℃时,SO2的最高吸收率最大,温度高于40℃后,温度升高,SO2的最高吸收率减小,只能是有关物质浓度改变所致,温度升高,Fe3+水解程度越大,c(Fe3+)减小、c(H+)增大,平衡2Fe3++SO2+2H2O![]() 2Fe2++SO42-+4H+向逆反应方向移动,SO2的最高吸收率减小。
2Fe2++SO42-+4H+向逆反应方向移动,SO2的最高吸收率减小。


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. 在常温、常压下,11.2 L N2含有的分子数为0.5NA
B. 标准状况下,22.4 L H2和O2的混合气体所含分子数为NA
C. 18 g H2O的物质的量是1mol
D. 标况下,1 mol SO2的体积是22.4 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过以下反应可获得新型能源二甲醚(CH3OCH3)。下列说法不正确的是
①C(s) + H2O(g)==CO(g)+H2(g) ΔH1=a kJmol-1
②CO(g) + H2O(g)==CO2(g)+H2(g) ΔH2=b kJmol-1
③CO2(g)+3H2(g)==CH3OH(g)+H2O(g) ΔH3 =c kJmol-1
④2CH3OH(g) ==CH3OCH3(g)+H2O(g) ΔH4=d kJmol-1
A. 反应①②为反应③提供原料气
B. 反应③也是CO2资源化利用的方法之一
C. 反应CH3OH(g)== ![]() CH3OCH3(g)+
CH3OCH3(g)+ ![]() H2O(1)的ΔH =
H2O(1)的ΔH =![]() kJmol-1
kJmol-1
D. 反应 2CO(g)+4H2(g) ==CH3OCH3(g)+H2O(g)的ΔH= (2b+2c+d) kJmol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】抗心律失常药物心律平的合成路线如下:

已知:① R-OH + Cl-R![]() R-O-R + HCl
R-O-R + HCl
②R-CHO+![]()
![]()
![]() + H2O
+ H2O
请回答:
(1)A属于链烃,则A中所含的官能团是______。
(2)B中无甲基,A→B的反应类型是______反应。
(3)C的结构简式是______。
(4)E中含有三元环,且无羟基,则D→E的化学方程式是______。
(5)结合官能团的性质,解释F→G的转化中需酸化的原因:______。
(6)H的结构简式是______。
(7)I→J的化学方程式是______。
(8)在I→J的反应中,生成J的同时会有副产物K,K与J互为同分异构体,则K的结构简式是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在3个体积均为1 L的恒容密闭容器中发生反应:SO2(g)+2NO(g)![]() 2NO2(g)+S(s)。改变容器I的反应温度,平衡时c( NO2)与温度的关系如下图所示。下列说法正确的是
2NO2(g)+S(s)。改变容器I的反应温度,平衡时c( NO2)与温度的关系如下图所示。下列说法正确的是


A. 该反应的ΔH<0
B. T1时,该反应的平衡常数为![]()
C. 容器Ⅰ与容器Ⅱ均在T1时达到平衡,总压强之比小于1:2
D. 若T2<T1,达到平衡时,容器Ⅲ中NO的体积分数小于40%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用如下反应制取P4:2Ca(PO4)2 +6SiO2+10C![]() 6CaSiO3+P4+10CO
6CaSiO3+P4+10CO
回答下列问题:
(1)基态硅原子的核外电子排布式为___。
(2)Si、P、S元素第一电离能大小关系为___。
(3)P4中P原子的杂化方式是___ ,P4的空间结构为___ ,键角∠PPP=___。
(4)与CO互为等电子的阴离子是___ (填化学式)。
(5)晶体硅与金刚石结构相似,下图为晶体硅的晶胞结构。已知硅原子的半径为r nm,晶体硅的密度是___g/cm3。
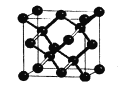
(6)硅的含氧化合物都以硅氧四面体(SiO4)作为基本结构单元,如图a所示,可简化为图b。

硅、氧原子通过共用氧原子形成各种不同的硅酸根负离子,如图c和图d,图c的化学式____________。在无限长链的硅酸根中硅氧原子之比为____。

硅、氧原子除可形成长链外,也可形成层状和立体网状结构。在立体网状结构中,硅、氧原子数之比为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸锌可作为食品锌强化剂的原料。工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量的Fe2O3、FeCO3、MgO、CaO等,生产工艺流程图如下:

(1)将菱锌矿研磨成粉的目的是___________________________。
(2)写出Fe3+水解的离子方程式_____________________________________________。
(3)根据下表数据,调节“滤液2”的pH时,理论上可选用的最大区间为__________。
沉淀化学式 | Mg(OH)2 | Zn(OH)2 | MgCO3 | CaCO3 |
开始沉淀的pH | 10.4 | 6.4 |
|
|
沉淀完全的pH | 12.4 | 8.0 |
|
|
开始溶解的pH |
| 10.5 |
|
|
Ksp | 5.6×10-12 |
| 6.8×10-6 | 2.8×10-9 |
(4)工业上从“滤液3”制取MgO过程中,合适的反应物是________选填序号。
A、大理石粉 B、石灰乳 C、纯碱溶液 D、氨水
(5)“滤液4”之后的操作依次为______________、______________、过滤、洗涤、干燥。
(6)分析图中数据,菱锌矿粉中ZnCO3的质量分数不低于__________用代数式表示。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列条件下,两瓶气体所含原子数不相等的是( )
A.同质量、不同密度的![]() 和COB.同温度、同压强、同体积的
和COB.同温度、同压强、同体积的![]() 和
和![]()
C.同体积、同密度的![]() 和
和![]() D.同质量、同体积的
D.同质量、同体积的![]() 和
和![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置可以用来发生、洗涤、干燥、收集(不考虑尾气处理)气体。该装置可用于( )

A.锌和盐酸生成氢气
B.氯酸钾和二氧化锰生成氧气
C.碳酸钙和盐酸生成二氧化碳
D.氯化钠和浓硫酸生成氯化氢
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com