
【题目】硫酸锌可作为食品锌强化剂的原料。工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量的Fe2O3、FeCO3、MgO、CaO等,生产工艺流程图如下:

(1)将菱锌矿研磨成粉的目的是___________________________。
(2)写出Fe3+水解的离子方程式_____________________________________________。
(3)根据下表数据,调节“滤液2”的pH时,理论上可选用的最大区间为__________。
沉淀化学式 | Mg(OH)2 | Zn(OH)2 | MgCO3 | CaCO3 |
开始沉淀的pH | 10.4 | 6.4 |
|
|
沉淀完全的pH | 12.4 | 8.0 |
|
|
开始溶解的pH |
| 10.5 |
|
|
Ksp | 5.6×10-12 |
| 6.8×10-6 | 2.8×10-9 |
(4)工业上从“滤液3”制取MgO过程中,合适的反应物是________选填序号。
A、大理石粉 B、石灰乳 C、纯碱溶液 D、氨水
(5)“滤液4”之后的操作依次为______________、______________、过滤、洗涤、干燥。
(6)分析图中数据,菱锌矿粉中ZnCO3的质量分数不低于__________用代数式表示。
【答案】增大反应物接触面积或增大反应速率或使反应更充分 Fe3++3H2O![]() Fe(OH)3+3H+ 8.0≤pH<10.4 BD 蒸发浓缩 冷却结晶 125m2/81m1
Fe(OH)3+3H+ 8.0≤pH<10.4 BD 蒸发浓缩 冷却结晶 125m2/81m1
【解析】
本题考查的是工业制备硫酸锌的相关知识和计算。
(1)根据影响化学反应速率的因素回答,固体表面积越大,反应速率越大;滤液1中混有Fe3+和Fe2+,调节pH,加入漂白精的目的是将Fe2+氧化为Fe3+,生成Fe(OH)3沉淀除去;(2)调节滤液2的pH要想生成Zn(OH)2沉淀而不生成Mg(OH)2,必须知道Mg(OH)2开始沉淀时的pH、Zn(OH)2沉淀完全的pH,以及Zn(OH)2开始溶解的pH;
(3)根据从溶液中制得干燥纯净的固体一般有蒸发、结晶、过滤后洗涤并干燥等操作来回答;
(4)利用关系式法来计算质量分数。
(1)将菱锌矿研磨成粉可以增加反应时的接触面积,使反应更加充分。本小题答案为:增大反应物接触面积或增大反应速率或使反应更充分。
(2)Fe3+水解的离子方程式为Fe3++3H2O![]() Fe(OH)3+3H+。本小题答案为:Fe3++3H2O
Fe(OH)3+3H+。本小题答案为:Fe3++3H2O ![]() Fe(OH)3+3H+。
Fe(OH)3+3H+。
(3)pH=8.0时Zn(OH)2完全沉淀,pH=10.5时开始溶解,而Mg(OH)2在pH=10.4时开始沉淀,为了使Zn(OH)2能完全析出且不影响Mg(OH)2,溶液的酸碱度应控制在8.0≤pH<10.4范围。本小题答案为:8.0≤pH<10.4。
(4)从“滤液3”制取MgO过程中,由于滤液中含有氯化镁,可以先加入石灰乳生成Mg(OH)2沉淀,然后加热氢氧化镁使其分解得到氧化镁;也可以加入碳酸钠溶液生成碳酸镁沉淀,然后加热碳酸镁使其分解得到氧化镁。如果加入氨水也能生成氢氧化镁,但是氢氧化镁能溶于较浓的氯化铵溶液,所以氨水不能把镁离子完全沉淀。大理石不能沉淀镁离子。综上所述,BD符合。本小题答案为:BD。
(5)“滤液4”之后的操作目的是为了得到纯净的七水合硫酸锌晶体,应将溶液蒸发浓缩至饱和溶液,然后冷却结晶、过滤、洗涤并干燥。本小题答案为:蒸发浓缩;冷却结晶。
(6)设碳酸锌的质量为m,利用关系式法计算:
ZnCO 3----ZnO
125 81
m m 2
ZnCO 3的质量为125m2/81,ZnCO 3的质量分数为 125m2/81m1。


 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案科目:高中化学 来源: 题型:
【题目】一种用于驱动潜艇的液氨-液氧燃料电池原理示意如图,下列有关该电池说法正确的是

A. 电子由电极A经外电路流向电极B
B. 该电池工作时,每消耗22.4L NH3转移3mol电子
C. 电池工作时,OH-向电极B移动
D. 电极B上发生的电极反应为:O2+ 4H++ 4e-=2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高炉炼铁过程中发生反应:![]() Fe2O3(s)+CO(g)
Fe2O3(s)+CO(g) ![]()
![]() Fe(s)+CO2(g),该反应在不同温度下的平衡常数见表。
Fe(s)+CO2(g),该反应在不同温度下的平衡常数见表。
温度T/℃ | 1000 | 1150 | 1300 |
平衡常数K | 4.0 | 3.7 | 3.5 |
下列说法正确的是
A. 增加高炉的高度可以有效降低炼铁尾气中CO的含量
B. 由表中数据可判断该反应:反应物的总能量>生成物的总能量
C. 为了使该反应的K增大,可以在其他条件不变时,增大c(CO)
D. 1000℃下Fe2O3与CO反应,t min达到平衡时c(CO) =2×10-3 mol/L,则用CO表示该反应的平均速率为![]() mol/(L·min)
mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸工业和合成氨工业是衡量一个国家工业发展水平的重要指标,下图是硫酸工业和合成氨工业联合生产示意图:

回答下列问题:
(1)已知:
4Fe(s)+3O2(g)=2Fe2O3(s) △H=akJ/mol
SO2 (g)=S(s)+O2(g)△H=bkJ/mol
Fe(s)+2S(s)=Fe2S(s)△H=ckJ/mol
沸腾炉中主要反应的热化学方程式为____。
(2)如果生产过程中H2的总转化率为90%,FeS2的总转化率为95%,氨与硫酸生成硫酸铵的转化率为100%,则最初FeS2和H2的物质的量之比为 ___。
(3)在一定条件下,分别向体积相同的恒容密闭容器甲,乙、丙中通入一定量的N2、H2或 NH3,发生反应:N2 (g)+3H2=2NH3 (g),相关数据如下:

①乙中NH3的转化率为 ___,丙中x的取值范围为 ___。
②在t1时升高甲容器的温度,至t2时再次达到平衡,测得t2时 混合气体的平均摩尔质量比tl时小。请在图中画出tl~t2 时间段正反应速率的变化示意图______________。

(4)尾气中含有SO2,直接排放会造成环境污染,可用Fe2(SO4)3 溶液吸收。某科研团队对pH、c(Fe3+)、温度等因素对SO2最 高吸收率的影响进行研究,结果如图:

40℃时SO2的最高吸收率随pH、c(Fe3+)的增大而 __,其原因是 ___;温度高于 40℃后,SO2的最高吸收率随温度的升高而减小,其原因是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究NO2、NO、SO2 、CO等大气污染气体的处理具有重要意义。
(1)已知: CO可将部分氮的氧化物还原为N2。
反应I :2CO(g)+2NO(g) ![]() N2(g)+2CO2(g) △H=-746kJ.mol-1
N2(g)+2CO2(g) △H=-746kJ.mol-1
反应II :4CO(g)+2NO2(g) ![]() N2(g)+4CO2(g) △H=-1200kJ.mol-1
N2(g)+4CO2(g) △H=-1200kJ.mol-1
则反应NO2(g)+CO(g) ![]() CO2(g)+NO(g)的△H=______kJ/mol。
CO2(g)+NO(g)的△H=______kJ/mol。
(2)一定条件下,将NO2与CO以体积比1:2置于密闭容器中发生反应II,下列能说明反应达到平衡状态的是________。
a.体系压强保持不变 b.容器中气体密度保持不变
c.混合气体颜色保持不变 d.每消耗2molNO2的同时生成1molN2
(3)温度为T、容积为10L的恒容密闭容器中,充入1molCO和0.5 mol SO2发生反应:2CO(g)+SO2(g)![]() 2CO2(g)+S(g) 实验测得生成的CO2体积分数(φ) 随着时间的变化曲线如图所示:
2CO2(g)+S(g) 实验测得生成的CO2体积分数(φ) 随着时间的变化曲线如图所示:
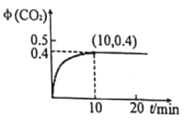
①达到平衡状态时,SO2的转化率为__,该温度下反应的平衡常数K=______。
②其它条件保持不变,再向上述平衡体系中充入SO2(g).CO(g)、S(g)、CO2(g)各0.2mol,此时v(正)___v(逆) (填“>”“<”或“=”)。
(4)SCR法是工业上消除氦氧化物的常用方法,反应原理为4NH3(g)+4NO(g)+O2(g)![]() 4N2(g)+6H2O(g) △H<0.在催化剂作用下,NO转化率与温度的关系如图所示:
4N2(g)+6H2O(g) △H<0.在催化剂作用下,NO转化率与温度的关系如图所示:

图中A点处NO的转化率_______(填“可能是”、“一定是 ”或“一定不是”)该温度下的平衡转化率;B点之后,NO转化率降低的原因可能是________。
A.平衡常数变大 B.副反应增多
C.催化剂活性降低 D.反应活化能增大
(5)2SO2(g)+O2(g) ![]() 2SO3(g) △H=-198kJ.mol-l 是制备硫酸的重要反应。在VL恒容密闭容器中充入2molSO2和1molO2,在不同条件下进行反应,反应体系总压强随时间的变化如图所示。a和b平衡时,SO3体积分数较大的是_______; 判断的依据是________。
2SO3(g) △H=-198kJ.mol-l 是制备硫酸的重要反应。在VL恒容密闭容器中充入2molSO2和1molO2,在不同条件下进行反应,反应体系总压强随时间的变化如图所示。a和b平衡时,SO3体积分数较大的是_______; 判断的依据是________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】臭氧层是地球生命的保护神,其中的臭氧(O3)和氧气(O2)是氧元素的两种单质。
(1)含有相同氧原子数的臭氧和氧气的物质的量之比为__________。
(2)同温同压时,相等质量的臭氧和氧气的密度之比为________,所占有的体积之比为__________,所含有的原子个数之比为_________。
(3)已知反应:O3 + 2KI + H2O = 2KOH + I2 + O2 。标准状况下的2.24L臭氧完全反应,生成的KOH的质量为_____克。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请回答下列问题:
(1)羰基铁[Fe(CO)5]会使合成甲醇和合成氨等生产过程中的催化剂中毒.Fe(CO)5常温下呈液态,熔点为﹣20.5℃,沸点为103℃,易溶于非极性溶剂.据此可以判断Fe(CO)5晶体类型为__。
(2)科学家通过X射线探明,MgO、CaO的晶体结构与NaCl晶体结构相似(如图所示)

①比较晶体熔点的高低MgO__CaO(填“高于”或“低于”),
②Mg2+的配位原子所构成的立体几何构型为__,③MgCO3晶格能大于CaCO3,为何MgCO3更易分解__。
(3)Ni的堆积与MgO中氧原子堆积相同,Ni可以吸附H2,氢以单个原子形式填入四面体空隙,则Ni最大量吸收H2后,n(Ni):n(H)=__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以太阳能为热源,热化学硫碘循环分解水是一种高效、环保的制氢方法,其流程图如下:

相关反应的热化学方程式为:
反应I:SO2(g) + I2(g) + 2H2O(l) === 2HI(aq) + H2SO4(aq) ΔH1 =﹣213 kJ·mol-1
反应II:H2SO4(aq) === SO2(g) + H2O(l) + ![]() O2(g) ΔH2 = +327 kJ·mol-1
O2(g) ΔH2 = +327 kJ·mol-1
反应III:2HI(aq) === H2(g) + I2(g) ΔH3 = +172 kJ·mol-1
下列说法不正确的是:
A. 该过程实现了太阳能到化学能的转化
B. SO2和I2对总反应起到了催化剂的作用
C. 总反应的热化学方程式为:2H2O(l) === 2H2 (g)+O2(g) ΔH = +286 kJ·mol-1
D. 该过程降低了水分解制氢反应的活化能,但总反应的ΔH不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙二酸俗名草酸,易溶于水,为了测定草酸晶体H2C2O4·xH2O中的x值,某实验小组进行实验,步骤如下:
①称取1.260g草酸晶体,配成100mL溶液。
②取25.00mL该H2C2O4溶液加入锥形瓶内,再加入适量稀硫酸。
③用浓度为0.1000mol/L的KMnO4标准溶液进行滴定,至滴定达到终点。
④重复实验。记录整理数据如下:
实验序号 | V(KMnO4溶液) | |
滴定前刻度/mL | 滴定后刻度/mL | |
1 | 0.10 | 10.00 |
2 | 1.10 | 11.10 |
3 | 1.50 | 13.50 |
4 | 0.70 | 10.80 |
回答下列问题:
(1)乙二酸和KMnO4标准溶液反应的离子方程式为____________
(2)步骤①需要使用烧杯、量筒、玻璃棒、胶头滴管,还缺少的玻璃仪器为_______(填名称);步骤③滴定过程中,盛装KMnO4溶液的仪器为__________________(填名称)。
(3)本实验滴定达到终点的标志是__________________________;
(4)根据数据,计算H2C2O4溶液的物质的量浓度为______mol/L,x=____________;
(5)若滴定终点时仰视滴定管刻度,则x值会_____________(填“偏大”、“偏小”或“不变”) 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com