
【题目】如图装置可以用来发生、洗涤、干燥、收集(不考虑尾气处理)气体。该装置可用于( )

A.锌和盐酸生成氢气
B.氯酸钾和二氧化锰生成氧气
C.碳酸钙和盐酸生成二氧化碳
D.氯化钠和浓硫酸生成氯化氢
 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案科目:高中化学 来源: 题型:
【题目】硫酸工业和合成氨工业是衡量一个国家工业发展水平的重要指标,下图是硫酸工业和合成氨工业联合生产示意图:

回答下列问题:
(1)已知:
4Fe(s)+3O2(g)=2Fe2O3(s) △H=akJ/mol
SO2 (g)=S(s)+O2(g)△H=bkJ/mol
Fe(s)+2S(s)=Fe2S(s)△H=ckJ/mol
沸腾炉中主要反应的热化学方程式为____。
(2)如果生产过程中H2的总转化率为90%,FeS2的总转化率为95%,氨与硫酸生成硫酸铵的转化率为100%,则最初FeS2和H2的物质的量之比为 ___。
(3)在一定条件下,分别向体积相同的恒容密闭容器甲,乙、丙中通入一定量的N2、H2或 NH3,发生反应:N2 (g)+3H2=2NH3 (g),相关数据如下:

①乙中NH3的转化率为 ___,丙中x的取值范围为 ___。
②在t1时升高甲容器的温度,至t2时再次达到平衡,测得t2时 混合气体的平均摩尔质量比tl时小。请在图中画出tl~t2 时间段正反应速率的变化示意图______________。

(4)尾气中含有SO2,直接排放会造成环境污染,可用Fe2(SO4)3 溶液吸收。某科研团队对pH、c(Fe3+)、温度等因素对SO2最 高吸收率的影响进行研究,结果如图:

40℃时SO2的最高吸收率随pH、c(Fe3+)的增大而 __,其原因是 ___;温度高于 40℃后,SO2的最高吸收率随温度的升高而减小,其原因是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以太阳能为热源,热化学硫碘循环分解水是一种高效、环保的制氢方法,其流程图如下:

相关反应的热化学方程式为:
反应I:SO2(g) + I2(g) + 2H2O(l) === 2HI(aq) + H2SO4(aq) ΔH1 =﹣213 kJ·mol-1
反应II:H2SO4(aq) === SO2(g) + H2O(l) + ![]() O2(g) ΔH2 = +327 kJ·mol-1
O2(g) ΔH2 = +327 kJ·mol-1
反应III:2HI(aq) === H2(g) + I2(g) ΔH3 = +172 kJ·mol-1
下列说法不正确的是:
A. 该过程实现了太阳能到化学能的转化
B. SO2和I2对总反应起到了催化剂的作用
C. 总反应的热化学方程式为:2H2O(l) === 2H2 (g)+O2(g) ΔH = +286 kJ·mol-1
D. 该过程降低了水分解制氢反应的活化能,但总反应的ΔH不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】了解并理解物质的内部结构以及化学键和晶体类型可以帮助我们更好地了解物质世界。已知:实验室用![]() 制氯化氢,溶于水形成盐酸。
制氯化氢,溶于水形成盐酸。
(1)写出原子的结构示意图Na_______,Cl______。
(2)NaCl电子式为___,所含化学键名称_____,属于______晶体;HCl电子式为____,所含化学键名称____,属于______晶体。
(3)氯化氢溶于水形成盐酸的电离方程式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KIO3 是一种重要的无机化合物,可作为食盐中的补碘剂。利用“KClO3 氧化法”制备 KIO3 工艺流程如下图所示,回答下列问题:
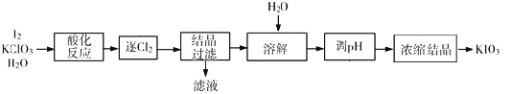
(1)“酸化反应”所得产物有 KH(IO3)2、Cl2 和 KCl。“逐 Cl2”采用的方法是________;
(2)“滤液”中的溶质主要是_______;“调 pH”中发生反应的化学方程式为_____________________;
(3)结晶过滤时工人发现 KH(IO3)2 为悬浮絮状沉淀,以下可以采用的方法是________;
A.倾析法 B.重结晶法 C.抽滤法 D. 离心分离法
(4)生产中,如果省去“酸化”、“逐氯”、“结晶①、过滤”这三步操作,直接用试剂 X 调整反应后溶液的 pH,对生产碘酸钾有什么具体影响_________________________________________________________________;
(5)KIO3 也可采用“电解法”制备,装置如图所示。与“电解法”相比,“KClO3 氧化法”的主要不足之处有_____________________________________;(写出一点)

(6)已知:KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O;I2+2S2O32-=2I-+S4O62-。测定加碘食盐中碘的含量,学生甲设计的实验步骤如下:
a.准确称取 w g 食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入过量 KI 溶液,使 KIO3 与 KI 反应完全;
c.以淀粉为指示剂,加入物质的量浓度为2.0×10-3mol·L-1 的 Na2S2O3 溶液 10.0mL 恰好反应。 则加碘食盐样品中的碘元素含量是______________mg/kg;(以含 w 的代数式表示)
(7)学生乙又对纯净的 NaCl(不含 KIO3)进行了下列实验:
操作步骤 | 实验现象 |
取 1g 纯净的 NaCl,加 3mL 水配成溶液。 | 溶液无变化 |
滴入 5 滴淀粉溶液和 1mL 0.1 mol·L-1KI 溶液,振荡。 | 溶液无变化 |
然后再滴入 1 滴 1mol·L-1 的 H2SO4,振荡。 | 溶液变蓝色 |
根据学生乙的实验结果,请对学生甲的实验结果作出简要评价___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在25℃时,AgCl的Ksp为1.8×10-10,Ag2S的Ksp为6.3×10-50,将AgCl与Ag2S的饱和溶液等体积混合,再加入足量浓AgNO3溶液,发生的反应为( )
A. 只有Ag2S沉淀生成 B. AgCl和Ag2S等物质的量生成
C. AgCl沉淀多于Ag2S沉淀 D. Ag2S沉淀多于AgCl沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙二酸俗名草酸,易溶于水,为了测定草酸晶体H2C2O4·xH2O中的x值,某实验小组进行实验,步骤如下:
①称取1.260g草酸晶体,配成100mL溶液。
②取25.00mL该H2C2O4溶液加入锥形瓶内,再加入适量稀硫酸。
③用浓度为0.1000mol/L的KMnO4标准溶液进行滴定,至滴定达到终点。
④重复实验。记录整理数据如下:
实验序号 | V(KMnO4溶液) | |
滴定前刻度/mL | 滴定后刻度/mL | |
1 | 0.10 | 10.00 |
2 | 1.10 | 11.10 |
3 | 1.50 | 13.50 |
4 | 0.70 | 10.80 |
回答下列问题:
(1)乙二酸和KMnO4标准溶液反应的离子方程式为____________
(2)步骤①需要使用烧杯、量筒、玻璃棒、胶头滴管,还缺少的玻璃仪器为_______(填名称);步骤③滴定过程中,盛装KMnO4溶液的仪器为__________________(填名称)。
(3)本实验滴定达到终点的标志是__________________________;
(4)根据数据,计算H2C2O4溶液的物质的量浓度为______mol/L,x=____________;
(5)若滴定终点时仰视滴定管刻度,则x值会_____________(填“偏大”、“偏小”或“不变”) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用电解饱和食盐水可制得重要化工产品。
(1)反应化学方程式为:___。
(2)电解饱和食盐水时,___极区附近溶液pH变大。
(3)取阴极区溶液作系列实验,下列结论中错误的是___。(填字母)
A.滴加石蕊试剂,溶液呈红色
B.滴加氯化镁溶液,有白色沉淀产生
C.加入石灰石,有气泡产生
D.先加足量硝酸,再滴加硝酸银溶液,若产生沉淀说明溶液中含有氯离子
(4)电解饱和食盐水一段时间后,想要让溶液恢复电解前的状态,应往溶液中加入(或通入)一定量的___(填字母)。
A.NaCl固体 B.NaCl溶液 C.HCl气体 D.盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 向0.1 mol·L1的氨水中加少量硫酸铵固体,则溶液中![]() 增大
增大
B. 常温下,0.1 mol·L1一元酸(HA)溶液pH=3,则该溶液中,c2(H+)=c(H+)×c(A)+KW
C. 向含有1 mol KAl(SO4)2的溶液中加入Ba(OH)2溶液得到沉淀的物质的量最多为 2 mol
D. 将Ca(ClO)2、Na2SO3、FeCl3、NaAlO2溶液蒸干均得不到原溶质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com