
【题目】已知在25℃时,AgCl的Ksp为1.8×10-10,Ag2S的Ksp为6.3×10-50,将AgCl与Ag2S的饱和溶液等体积混合,再加入足量浓AgNO3溶液,发生的反应为( )
A. 只有Ag2S沉淀生成 B. AgCl和Ag2S等物质的量生成
C. AgCl沉淀多于Ag2S沉淀 D. Ag2S沉淀多于AgCl沉淀
 灵星计算小达人系列答案
灵星计算小达人系列答案科目:高中化学 来源: 题型:
【题目】工业上利用如下反应制取P4:2Ca(PO4)2 +6SiO2+10C![]() 6CaSiO3+P4+10CO
6CaSiO3+P4+10CO
回答下列问题:
(1)基态硅原子的核外电子排布式为___。
(2)Si、P、S元素第一电离能大小关系为___。
(3)P4中P原子的杂化方式是___ ,P4的空间结构为___ ,键角∠PPP=___。
(4)与CO互为等电子的阴离子是___ (填化学式)。
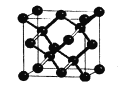
(5)晶体硅与金刚石结构相似,下图为晶体硅的晶胞结构。已知硅原子的半径为r nm,晶体硅的密度是___g/cm3。
(6)硅的含氧化合物都以硅氧四面体(SiO4)作为基本结构单元,如图a所示,可简化为图b。

硅、氧原子通过共用氧原子形成各种不同的硅酸根负离子,如图c和图d,图c的化学式____________。在无限长链的硅酸根中硅氧原子之比为____。

硅、氧原子除可形成长链外,也可形成层状和立体网状结构。在立体网状结构中,硅、氧原子数之比为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组为了探究一种有机盐 X(仅含四种元素)的组成与性质,设计并完成如下实验:

已知: A、 B、 C 均为常见物质。气体 A 为无色无味混合气体,两种气体组成元素相同。
(1)有机盐 X 的化学式为_________
(2)写出 X 受热分解的化学方程式_________
(3)一定条件下,固体 C 与气体 A 中的某一成分可能发生某一氧化还原反应生成红棕色_________固体,写出此反应可能的化学方程式_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下浓度均为0.1 mol·L-1的下列溶液的pH如表:
溶质 | NaF | Na2CO3 | NaClO | NaHCO3 |
pH | 8.1 | 11.6 | 9.7 | 8.4 |
下列有关说法正确的是( )
A. 在相同温度下,同浓度的三种酸溶液的导电能力顺序:H2CO3<HClO<HF
B. 等体积、等物质的量浓度的NaClO溶液与NaF溶液中离子总数大小:N前<N后
C. 若将少量CO2通入NaClO溶液至溶液中,离子方程式为:ClO-+CO2+H2O=HClO+CO32-
D. 向Na2CO3溶液中通入少量的HF气体,化学方程式为Na2CO3+2HF = CO2+H2O+2NaF
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置可以用来发生、洗涤、干燥、收集(不考虑尾气处理)气体。该装置可用于( )

A.锌和盐酸生成氢气
B.氯酸钾和二氧化锰生成氧气
C.碳酸钙和盐酸生成二氧化碳
D.氯化钠和浓硫酸生成氯化氢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将等浓度等体积的弱酸HA和HB与NaHCO3反应放出CO2的体积与时间的关系如图所示,则以下说法错误的是:( )

A. 酸性:HA<HB
B. pH均为4的HA和HB溶液中和等量NaOH时,所需HA溶液体积小
C. pH均为9的NaA溶液和NaB溶液相比,NaA溶液中水的电离程度大
D. 浓度均为0.1mol/L的NaA溶液和NaB溶液相比,NaA溶液中水的电离程度大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】深入研究碳元素的化合物有重要意义,回答下列问题:
(1)在恒温、恒容密闭容器中加入H2C2O4,发生反应:H2C2O4(s)![]() CO2(g)+CO(g)+H2O(g),下列叙述能说明反应已经达到平衡状态的是________。
CO2(g)+CO(g)+H2O(g),下列叙述能说明反应已经达到平衡状态的是________。
A.压强不再变化
B.CO2(g)的体积分数保持不变
C.混合气体的密度不再变化
D.混合气体的平均摩尔质量保持不变
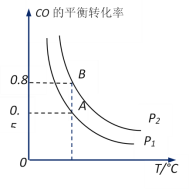
(2)工业上可以通过反应CO(g)+2H2(g)![]() CH3OH(g)制备甲醇。在一容积可变容器中充入2molCO和4molH2,CO的平衡转 化率随温度(T)、压强(P)的变化关系如图所示。该反应的H_______0(填“>”、“<”或“=”),比较A点时用CO表示的正反应速率与B点时用CH3OH表示的逆反应速率的大小v正(CO)____v逆(CH3OH)(填“>”、“<”或“=”)。若在压强P1下达到化学平衡状态A时,容器的体积为10L。如果反应开始时仍充入2molCO和4molH2,则在压强P2下达到平衡状态B时容器的体积V(B)=________L。
CH3OH(g)制备甲醇。在一容积可变容器中充入2molCO和4molH2,CO的平衡转 化率随温度(T)、压强(P)的变化关系如图所示。该反应的H_______0(填“>”、“<”或“=”),比较A点时用CO表示的正反应速率与B点时用CH3OH表示的逆反应速率的大小v正(CO)____v逆(CH3OH)(填“>”、“<”或“=”)。若在压强P1下达到化学平衡状态A时,容器的体积为10L。如果反应开始时仍充入2molCO和4molH2,则在压强P2下达到平衡状态B时容器的体积V(B)=________L。
(3)从平衡移动的角度分析AlCl3溶液可以溶解CaCO3固体的原因是_________________
(4)常温下,测得某CaCO3的饱和溶液pH=10.0,忽略CO32-的第二步水解,计算Ksp(CaCO3)=__________(保留三位有效数字)(已知:Ka1(H2CO3)=4.4×10-7Ka2(H2CO3)=4.7×10-11)
(5)有一种可充电电池Na-Al/FeS,电池工作时Na+的物质的量保持不变,并且用含Na+的导电固体作为电解质,已知该电池的正极反应式为2Na++FeS+2e-=Na2S+Fe, 则放电时负极反应式为____________________。该电池充电时,当转移2mol电子时,阳极质量的变化量为______g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)工业上制备氯化氢气体的化学方程式为___。
(2)实验室用氯化钠与浓硫酸反应制氯化氢气体的方程式___,利用浓硫酸___性。要制得干燥的氯化氢气体,可选用___做干燥剂。
(3)用如图装置进行实验,烧瓶内充满干燥的HCl气体,挤压预先装满水的胶头滴管后,还应该进行的操作是___,能观察到___现象。

(4)标准状况下,用容积为V升的圆底烧瓶,采用排空气法收集干燥的氯化氢,所得气体的平均式量是34.625。喷泉实验后,烧瓶中的溶液的体积为___,物质的量浓度___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列事实中,各是什么因素影响了化学反应的速率。
(1)黄铁矿煅烧时要粉碎成细小颗粒______________;
(2)夏天的食品变霉,在冬天不易发生该现象_____________;
(3)同浓度同体积的盐酸中放入同样大小的锌粒和镁块,产生气体快慢程度不同__;
(4)同样大小的石灰石分别在0.1 mol·L-1的盐酸和1 mol·L-1的盐酸中反应速度不同_____________;
(5)熔化的KClO3放出气泡很慢,撒入MnO2少量很快产生气体__________;
(6)如下图,铁在海水中的腐蚀速度是②比①快______。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com