
【题目】深入研究碳元素的化合物有重要意义,回答下列问题:
(1)在恒温、恒容密闭容器中加入H2C2O4,发生反应:H2C2O4(s)![]() CO2(g)+CO(g)+H2O(g),下列叙述能说明反应已经达到平衡状态的是________。
CO2(g)+CO(g)+H2O(g),下列叙述能说明反应已经达到平衡状态的是________。
A.压强不再变化
B.CO2(g)的体积分数保持不变
C.混合气体的密度不再变化
D.混合气体的平均摩尔质量保持不变
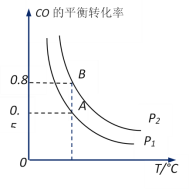
(2)工业上可以通过反应CO(g)+2H2(g)![]() CH3OH(g)制备甲醇。在一容积可变容器中充入2molCO和4molH2,CO的平衡转 化率随温度(T)、压强(P)的变化关系如图所示。该反应的H_______0(填“>”、“<”或“=”),比较A点时用CO表示的正反应速率与B点时用CH3OH表示的逆反应速率的大小v正(CO)____v逆(CH3OH)(填“>”、“<”或“=”)。若在压强P1下达到化学平衡状态A时,容器的体积为10L。如果反应开始时仍充入2molCO和4molH2,则在压强P2下达到平衡状态B时容器的体积V(B)=________L。
CH3OH(g)制备甲醇。在一容积可变容器中充入2molCO和4molH2,CO的平衡转 化率随温度(T)、压强(P)的变化关系如图所示。该反应的H_______0(填“>”、“<”或“=”),比较A点时用CO表示的正反应速率与B点时用CH3OH表示的逆反应速率的大小v正(CO)____v逆(CH3OH)(填“>”、“<”或“=”)。若在压强P1下达到化学平衡状态A时,容器的体积为10L。如果反应开始时仍充入2molCO和4molH2,则在压强P2下达到平衡状态B时容器的体积V(B)=________L。
(3)从平衡移动的角度分析AlCl3溶液可以溶解CaCO3固体的原因是_________________
(4)常温下,测得某CaCO3的饱和溶液pH=10.0,忽略CO32-的第二步水解,计算Ksp(CaCO3)=__________(保留三位有效数字)(已知:Ka1(H2CO3)=4.4×10-7Ka2(H2CO3)=4.7×10-11)
(5)有一种可充电电池Na-Al/FeS,电池工作时Na+的物质的量保持不变,并且用含Na+的导电固体作为电解质,已知该电池的正极反应式为2Na++FeS+2e-=Na2S+Fe, 则放电时负极反应式为____________________。该电池充电时,当转移2mol电子时,阳极质量的变化量为______g。
【答案】AC < < 2 CaCO3(s) ![]() Ca2+ (aq)+ CO32-(aq),Al3+ 水解显酸性,溶液中H+与CO32-结合,促进CaCO3的溶解平衡向右移,使CaCO3溶解 6.91×10-9 2Na-2e-=2Na+ 46
Ca2+ (aq)+ CO32-(aq),Al3+ 水解显酸性,溶液中H+与CO32-结合,促进CaCO3的溶解平衡向右移,使CaCO3溶解 6.91×10-9 2Na-2e-=2Na+ 46
【解析】
(1)恒容密闭容器中,保持温度不变,
A、反应H2C2O4 (s)H2O(g)+CO(g)+CO2(g)是一个气体体积增大的反应,恒容时,容器的压强不再变化,说明该反应已达到化学平衡状态,故A正确;
B、在反应H2C2O4 (s)H2O(g)+CO(g)+CO2(g)中,CO2(g)的体积分数始终保持不变,不能说明该反应已达到化学平衡状态,故B错误;
C、密度=![]() ,气体的总质量会变,体积不变,混合气体的密度不再变化能说明该反应已达到化学平衡状态,故C正确;
,气体的总质量会变,体积不变,混合气体的密度不再变化能说明该反应已达到化学平衡状态,故C正确;
D、生成物气体是按照固定比例生成的,气体平均摩尔质量不发生变化,所以当气体平均摩尔质量不再发生变化,不能说明该反应已达到化学平衡状态,故D错误。
(2)根据图象可知,温度升高CO的平衡转化率下降,所以为放热反应,H<0;
CO(g)+2H2(g)CH3OH(g)正反应是气体体积减小的方向,当其他条件不变时,增大压强,平衡向正反应方向移动,CO的平衡转化率增大,由图可知A点CO的平衡转化率比B点CO的平衡转化率小,说明P1< P2,当其他条件不变时,压强越高,反应速率越快,则v正(CO) <v逆(CH3OH);
利用A点时CO的转化率为50%,
CO(g)+2H2(g)CH3OH(g)
起始(mol):2 4 0
转化(mol):1 2 1
平衡(mol):1 2 1
K=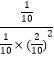 =25
=25
A、B两容器温度相同,即化学平衡常数相等,且B点时CO的转化率为0.8,
则 CO(g)+2H2(g)CH3OH(g)
起始(mol):2 4 0
转化(mol):1.6 3.2 1.6
平衡(mol):0.4 0.8 1.6
设体积为VL,则有K=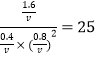 得V=2L
得V=2L
(3)CaCO3(s) ![]() Ca2+ (aq)+ CO32-(aq),Al3+ 水解显酸性,溶液中H+与CO32-结合,促进CaCO3的溶解平衡向右移,使CaCO3溶解;
Ca2+ (aq)+ CO32-(aq),Al3+ 水解显酸性,溶液中H+与CO32-结合,促进CaCO3的溶解平衡向右移,使CaCO3溶解;
(4)由Ka2(H2CO3)=4.7×10-11可知CO32-+H2OHCO3-+OH-的水解Kh=![]()
常温下,测得CaCO3与水形成的浊液pH为10,c(HCO3-)=c(OH-)=1×10-4,
可知c(CO32-)=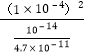 =
=![]()
又c(Ca2+)=c/span>(CO32-)+c(HCO3-)=![]()
Ksp(CaCO3)=c(Ca2+)×c(CO32-)=![]() ×
×![]() =6.91×10-9
=6.91×10-9
(5)Na性质活泼,易失去电子而被氧化,应为原电池的负极,电极方程式为2Na-2e-=2Na+;充电时,阳极发生氧化反应,电极方程式为
Na2S+Fe-2e-=2Na++FeS △m
2mol 46g
该电池充电时,当转移2mol电子时,阳极质量的变化量为46g。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】臭氧层是地球生命的保护神,其中的臭氧(O3)和氧气(O2)是氧元素的两种单质。
(1)含有相同氧原子数的臭氧和氧气的物质的量之比为__________。
(2)同温同压时,相等质量的臭氧和氧气的密度之比为________,所占有的体积之比为__________,所含有的原子个数之比为_________。
(3)已知反应:O3 + 2KI + H2O = 2KOH + I2 + O2 。标准状况下的2.24L臭氧完全反应,生成的KOH的质量为_____克。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】了解并理解物质的内部结构以及化学键和晶体类型可以帮助我们更好地了解物质世界。已知:实验室用![]() 制氯化氢,溶于水形成盐酸。
制氯化氢,溶于水形成盐酸。
(1)写出原子的结构示意图Na_______,Cl______。
(2)NaCl电子式为___,所含化学键名称_____,属于______晶体;HCl电子式为____,所含化学键名称____,属于______晶体。
(3)氯化氢溶于水形成盐酸的电离方程式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在25℃时,AgCl的Ksp为1.8×10-10,Ag2S的Ksp为6.3×10-50,将AgCl与Ag2S的饱和溶液等体积混合,再加入足量浓AgNO3溶液,发生的反应为( )
A. 只有Ag2S沉淀生成 B. AgCl和Ag2S等物质的量生成
C. AgCl沉淀多于Ag2S沉淀 D. Ag2S沉淀多于AgCl沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙二酸俗名草酸,易溶于水,为了测定草酸晶体H2C2O4·xH2O中的x值,某实验小组进行实验,步骤如下:
①称取1.260g草酸晶体,配成100mL溶液。
②取25.00mL该H2C2O4溶液加入锥形瓶内,再加入适量稀硫酸。
③用浓度为0.1000mol/L的KMnO4标准溶液进行滴定,至滴定达到终点。
④重复实验。记录整理数据如下:
实验序号 | V(KMnO4溶液) | |
滴定前刻度/mL | 滴定后刻度/mL | |
1 | 0.10 | 10.00 |
2 | 1.10 | 11.10 |
3 | 1.50 | 13.50 |
4 | 0.70 | 10.80 |
回答下列问题:
(1)乙二酸和KMnO4标准溶液反应的离子方程式为____________
(2)步骤①需要使用烧杯、量筒、玻璃棒、胶头滴管,还缺少的玻璃仪器为_______(填名称);步骤③滴定过程中,盛装KMnO4溶液的仪器为__________________(填名称)。
(3)本实验滴定达到终点的标志是__________________________;
(4)根据数据,计算H2C2O4溶液的物质的量浓度为______mol/L,x=____________;
(5)若滴定终点时仰视滴定管刻度,则x值会_____________(填“偏大”、“偏小”或“不变”) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化合物H的合成路线如下:
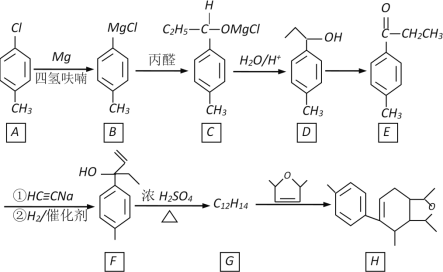
已知CH≡CH在NaNH2液氨条件下可生成CH≡CNa或NaC≡CNa
(1)A的化学名称是________________________,B→C的反应类型是________________
(2)D→E的反应试剂、条件是________,F中不含氧官能团名称是____________
(3)H的分子式是___________________
(4)F→G的化学方程式是________________
(5)W是E的同系物,比E少一个碳原子,则符合下列条件的W的同分异构体的结构简式是___________(写一种)
①有两种官能团
②遇FeCl3溶液显紫色
③核磁共振氢谱有五组峰,峰面积之比是3︰2︰2︰2︰1
(6)依据上述题目信息,写出用乙醛和乙炔为原料,制备化合物![]() 的合成路线(无机试剂任选)_________。
的合成路线(无机试剂任选)_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用电解饱和食盐水可制得重要化工产品。
(1)反应化学方程式为:___。
(2)电解饱和食盐水时,___极区附近溶液pH变大。
(3)取阴极区溶液作系列实验,下列结论中错误的是___。(填字母)
A.滴加石蕊试剂,溶液呈红色
B.滴加氯化镁溶液,有白色沉淀产生
C.加入石灰石,有气泡产生
D.先加足量硝酸,再滴加硝酸银溶液,若产生沉淀说明溶液中含有氯离子
(4)电解饱和食盐水一段时间后,想要让溶液恢复电解前的状态,应往溶液中加入(或通入)一定量的___(填字母)。
A.NaCl固体 B.NaCl溶液 C.HCl气体 D.盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海带具有从海水中富集碘的能力。下面是从海带中提取碘单质的流程:
海带![]() 海带灰
海带灰![]() 悬浊液
悬浊液![]() 含I-的溶液
含I-的溶液![]() 含I2的溶液
含I2的溶液![]() 含I2的四氯化碳溶液
含I2的四氯化碳溶液![]() 晶体碘
晶体碘
(1)在上述流程中,属于过滤操作的是___(用a、b、c、d表示,下同),属于萃取操作的是___。
(2)现有烧杯、玻璃棒和必需的夹持仪器,完成过滤操作尚缺少的玻璃仪器是___,完成萃取操作还需要的玻璃仪器是___。
(3)写出含I-的溶液中通氯气后发生反应的离子方程式:___。
(4)含I2的水溶液中加入四氯化碳,振荡后静置,观察到溶液分层,下层溶液显___。
(5)四氯化碳能从碘水中萃取出碘的原因是①___,②___,③___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高分子合物J的合成路线如下:

已知:i、
ii、
(1)写出E的名称:_____________,由G生成H的反应类型为:______________。
(2)I中官能团名称:____________________。B→C的反应条件为:___________。
(3)由I可合成有机物K,K中含有3个六元环,写出I合成K的化学方程式:____________________________________________________。
(4)D→E反应的化学方程式:_____________________________。
(5)有机物L(C9H10O3)符合下列条件的同分异构体有______种。
①与FeCl3溶液发生显色反应
②与I具有相同的官能团
③苯环上有3个取代基
(6)结合上述流程中的信息,设计由![]() 制备
制备 的合成路线_____。合成路线流程图示例:
的合成路线_____。合成路线流程图示例:![]() 。
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com