
【题目】某化合物H的合成路线如下:
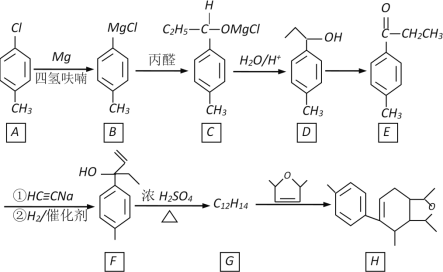
已知CH≡CH在NaNH2液氨条件下可生成CH≡CNa或NaC≡CNa
(1)A的化学名称是________________________,B→C的反应类型是________________
(2)D→E的反应试剂、条件是________,F中不含氧官能团名称是____________
(3)H的分子式是___________________
(4)F→G的化学方程式是________________
(5)W是E的同系物,比E少一个碳原子,则符合下列条件的W的同分异构体的结构简式是___________(写一种)
①有两种官能团
②遇FeCl3溶液显紫色
③核磁共振氢谱有五组峰,峰面积之比是3︰2︰2︰2︰1
(6)依据上述题目信息,写出用乙醛和乙炔为原料,制备化合物![]() 的合成路线(无机试剂任选)_________。
的合成路线(无机试剂任选)_________。
【答案】对氯甲苯(4-氯甲苯) 加成反应 Cu、O2,加热 碳碳双键 C18H24O 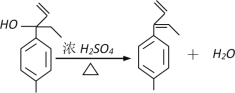
![]()
![]()
【解析】
A→B生成格式试剂;B→C为丙醛断开C=O双键发生加成反应,烃基加在碳原子上,-MgX加在O原子上;C→D产物中氢原子(-H)取代-MgX即发生取代反应,水解得到醇;D→E反应物中的羟基变成了羰基,醇发生氧化反应生成酮;E→F①乙炔钠(CH≡CNa)在一定条件下可以和某些羰基发生加成反应,加成时乙炔钠中Na原子与羰基氧原子相连,—C≡CH与羰基碳原子相连,②在H2、催化剂作用下,—ONa变成—OH,生成醇;F→G反应物中—OH消失,产物出现碳碳双键,反应条件浓硫酸加热,醇发生消去反应; G→H共轭二烯烃与单烯烃发生1,4-成环加成反应。
(1)苯环上两个相同取代基的位置可用“邻”、“间”、“对”表示,苯环上连接简单烃基、硝基(-NO2)、卤素(-X)时,以苯环为母体。所以![]() 命名为对氯甲苯(4-氯甲苯);由分析可知反应类型为加成反应;
命名为对氯甲苯(4-氯甲苯);由分析可知反应类型为加成反应;
(2)由分析可知反应的试剂和条件为Cu、O2,加热 ; F中官能团碳碳双键和羟基,不含氧官能团为碳碳双键;
(3) 中C原子数,H原子数,O原子数分别为18、24、1,化学式为C18H24O;
中C原子数,H原子数,O原子数分别为18、24、1,化学式为C18H24O;
(4)苄型醇脱水以形成稳定共轭体系的烯烃为主要产物,所以化学方程式为 ;
;
(5) E的分子式是C10H12O,W是E的同系物,比E少一个碳原子,所以W的分子式是C9H10O,①有两种官能团,②遇FeCl3溶液显示特征颜色紫色,说明其结构含有苯环和酚羟基,③核磁共振氢谱有五组峰,含有5种氢原子,峰面积之比为3︰2︰2︰2︰1,氢原子个数比为3︰2︰2︰2︰1,则符合下列条件的W的同分异构体的结构简式是![]() ;
;
(6) 根据题目提供的信息可知, CH≡CH在NaNH2液氨条件下可生成NaC≡CNa,NaC≡CNa在一定条件下可以和乙醛中羰基发生加成反应,在H2、催化剂作用下,生成醇,二醇分子内脱水生成—O—,所以反应历程为: ![]() 。
。


 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:
【题目】同周期的X、Y、Z三种元素的最高价氧化物对应水化物的酸性由强到弱的顺序是:HZO4![]() H2YO4
H2YO4 ![]() H3XO4,下列判断正确的是 ( )
H3XO4,下列判断正确的是 ( )
①阴离子的还原性按X、Y、Z顺序减弱
②单质的氧化性按X、Y、Z顺序增强
③元素的原子半径按X、Y、Z顺序减小
④气态氢化物的稳定性按X、Y、Z顺序减弱
①②A. ②③ B. ①②③ C. ①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下浓度均为0.1 mol·L-1的下列溶液的pH如表:
溶质 | NaF | Na2CO3 | NaClO | NaHCO3 |
pH | 8.1 | 11.6 | 9.7 | 8.4 |
下列有关说法正确的是( )
A. 在相同温度下,同浓度的三种酸溶液的导电能力顺序:H2CO3<HClO<HF
B. 等体积、等物质的量浓度的NaClO溶液与NaF溶液中离子总数大小:N前<N后
C. 若将少量CO2通入NaClO溶液至溶液中,离子方程式为:ClO-+CO2+H2O=HClO+CO32-
D. 向Na2CO3溶液中通入少量的HF气体,化学方程式为Na2CO3+2HF = CO2+H2O+2NaF
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将等浓度等体积的弱酸HA和HB与NaHCO3反应放出CO2的体积与时间的关系如图所示,则以下说法错误的是:( )

A. 酸性:HA<HB
B. pH均为4的HA和HB溶液中和等量NaOH时,所需HA溶液体积小
C. pH均为9的NaA溶液和NaB溶液相比,NaA溶液中水的电离程度大
D. 浓度均为0.1mol/L的NaA溶液和NaB溶液相比,NaA溶液中水的电离程度大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】深入研究碳元素的化合物有重要意义,回答下列问题:
(1)在恒温、恒容密闭容器中加入H2C2O4,发生反应:H2C2O4(s)![]() CO2(g)+CO(g)+H2O(g),下列叙述能说明反应已经达到平衡状态的是________。
CO2(g)+CO(g)+H2O(g),下列叙述能说明反应已经达到平衡状态的是________。
A.压强不再变化
B.CO2(g)的体积分数保持不变
C.混合气体的密度不再变化
D.混合气体的平均摩尔质量保持不变
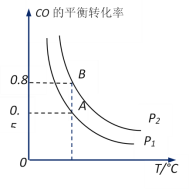
(2)工业上可以通过反应CO(g)+2H2(g)![]() CH3OH(g)制备甲醇。在一容积可变容器中充入2molCO和4molH2,CO的平衡转 化率随温度(T)、压强(P)的变化关系如图所示。该反应的H_______0(填“>”、“<”或“=”),比较A点时用CO表示的正反应速率与B点时用CH3OH表示的逆反应速率的大小v正(CO)____v逆(CH3OH)(填“>”、“<”或“=”)。若在压强P1下达到化学平衡状态A时,容器的体积为10L。如果反应开始时仍充入2molCO和4molH2,则在压强P2下达到平衡状态B时容器的体积V(B)=________L。
CH3OH(g)制备甲醇。在一容积可变容器中充入2molCO和4molH2,CO的平衡转 化率随温度(T)、压强(P)的变化关系如图所示。该反应的H_______0(填“>”、“<”或“=”),比较A点时用CO表示的正反应速率与B点时用CH3OH表示的逆反应速率的大小v正(CO)____v逆(CH3OH)(填“>”、“<”或“=”)。若在压强P1下达到化学平衡状态A时,容器的体积为10L。如果反应开始时仍充入2molCO和4molH2,则在压强P2下达到平衡状态B时容器的体积V(B)=________L。
(3)从平衡移动的角度分析AlCl3溶液可以溶解CaCO3固体的原因是_________________
(4)常温下,测得某CaCO3的饱和溶液pH=10.0,忽略CO32-的第二步水解,计算Ksp(CaCO3)=__________(保留三位有效数字)(已知:Ka1(H2CO3)=4.4×10-7Ka2(H2CO3)=4.7×10-11)
(5)有一种可充电电池Na-Al/FeS,电池工作时Na+的物质的量保持不变,并且用含Na+的导电固体作为电解质,已知该电池的正极反应式为2Na++FeS+2e-=Na2S+Fe, 则放电时负极反应式为____________________。该电池充电时,当转移2mol电子时,阳极质量的变化量为______g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应mA(s)+nB(g)![]() pC(g) △H<0,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,下列叙述中一定正确的是
pC(g) △H<0,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,下列叙述中一定正确的是

①m+n>p ②x点表示的正反应速率大于逆反应速率
③n>p ④x点比y点时的反应速率慢
⑤若升高温度,该反应的平衡常数增大
A. ①②⑤ B. 只有②④ C. 只有①③ D. ①③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)工业上制备氯化氢气体的化学方程式为___。
(2)实验室用氯化钠与浓硫酸反应制氯化氢气体的方程式___,利用浓硫酸___性。要制得干燥的氯化氢气体,可选用___做干燥剂。
(3)用如图装置进行实验,烧瓶内充满干燥的HCl气体,挤压预先装满水的胶头滴管后,还应该进行的操作是___,能观察到___现象。

(4)标准状况下,用容积为V升的圆底烧瓶,采用排空气法收集干燥的氯化氢,所得气体的平均式量是34.625。喷泉实验后,烧瓶中的溶液的体积为___,物质的量浓度___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知元素A的一价阴离子的电子层结构与氩原子相同,元素B的二价阳离子的电子层结构与氖原子相同。请回答:
(1)元素A离子的结构示意图为___,A的单质呈___色,检验该物质的方法是___。
(2)由A、B形成的化合物的电子式是___。
(3)与A离子具有相同电子数的一种分子是___(填名称)。
(4)A的单质与Ca(OH)2反应的化学方程式___,该反应工业上的用途是___。
(5)蓝色石蕊试纸遇到A的水溶液现象是___,请你解释这个现象___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)常温下,将0.2 mol·L-1的某一元酸HA溶液和0.1 mol·L-1NaOH溶液等体积混合后溶液pH大于7,若混合液体积等于两溶液体积之和,则混合液中下列关系正确的是________。
A.c(HA)<c(A-) B.c(HA)一定大于0.1 mol·L-1
C.c(Na+)=c(HA)+c(A-) D.2c(OH-)=2c(H+)+[c(HA)-c(A-)]
(2)在t℃时,某NaOH稀溶液中c(H+)=10-a mol·L-1,c(OH-)=10-b mol·L-1,已知a+b=12,则:
①该温度下水的离子积常数Kw=___________mol2·L-2。
②在该温度下,将100mL0.1 mol·L-1的稀H2SO4与100mL0.4 mol·L-1的NaOH溶液混合后,溶液的pH= _____________。
(3)常温下在20 mL 0.1 mol·L-1Na2CO3溶液中逐滴加入0.1 mol·L-1HCl溶液40 mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数(纵轴)随溶液pH变化的部分情况如下图所示。

回答下列问题:
①在同一溶液中,H2CO3、HCO3-、CO32-________(填“能”或“不能”)大量共存。
②当pH=7时,溶液中各种离子其物质的量浓度之间的等量关系是__________________。
③已知在25 ℃时,CO32-水解反应的平衡常数Kh=c(HCO3-).c(OH-)/c(HCO3-)=2×10-4,当溶液中c(HCO3-)∶c-(CO32-)=2∶1时,溶液的pH=________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com