
【题目】(1)常温下,将0.2 mol·L-1的某一元酸HA溶液和0.1 mol·L-1NaOH溶液等体积混合后溶液pH大于7,若混合液体积等于两溶液体积之和,则混合液中下列关系正确的是________。
A.c(HA)<c(A-) B.c(HA)一定大于0.1 mol·L-1
C.c(Na+)=c(HA)+c(A-) D.2c(OH-)=2c(H+)+[c(HA)-c(A-)]
(2)在t℃时,某NaOH稀溶液中c(H+)=10-a mol·L-1,c(OH-)=10-b mol·L-1,已知a+b=12,则:
①该温度下水的离子积常数Kw=___________mol2·L-2。
②在该温度下,将100mL0.1 mol·L-1的稀H2SO4与100mL0.4 mol·L-1的NaOH溶液混合后,溶液的pH= _____________。
(3)常温下在20 mL 0.1 mol·L-1Na2CO3溶液中逐滴加入0.1 mol·L-1HCl溶液40 mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数(纵轴)随溶液pH变化的部分情况如下图所示。

回答下列问题:
①在同一溶液中,H2CO3、HCO3-、CO32-________(填“能”或“不能”)大量共存。
②当pH=7时,溶液中各种离子其物质的量浓度之间的等量关系是__________________。
③已知在25 ℃时,CO32-水解反应的平衡常数Kh=c(HCO3-).c(OH-)/c(HCO3-)=2×10-4,当溶液中c(HCO3-)∶c-(CO32-)=2∶1时,溶液的pH=________。
【答案】D 10-12 11 不能 c(Na+)+c(H+)=c(Cl-)+c(HCO![]() )+c(OH-) 10
)+c(OH-) 10
【解析】
(1)常温下, 将0.2 mol·L-1的某一元酸HA溶液和0.1 mol·L-1NaOH溶液等体积混合后,得到溶液溶质为NaA和HA,溶液pH大于7,说明A-离子水解程度大于HA电离程度;
(2)①根据水的离子积常数Kw=c(H+)×c(OH-)进行计算;
②由于硫酸与NaOH溶液混合后,碱过量,求出混合后溶液中c(OH-),再求c(H+),最后求出pH;
(3) 常温下在20 mL 0.1 mol·L-1Na2CO3溶液中逐滴加入0.1 mol·L-1HCl溶液40 mL,先反应生成碳酸氢钠,再与盐酸反应生成二氧化碳、水,以此分析解答。
(1)常温下,将0.2 mol·L-1的某一元酸HA溶液和0.1 mol·L-1NaOH溶液等体积混合后溶液pH大于7,则则盐类水解大于酸的电离;
A. 水解生成HA,则c(HA)>c(A-) ,故A错误;
B.因等体积混合,则反应后c(HA)一定小于0.1 mol·L-1,故B错误;
C.反应后得到等量的HA、NaA,根据物料守恒可知2c(Na+)=c(HA)+c(A-),故C错误;
D.由电荷守恒可以知道:c(Na+)+c(H+)=c(OH-)+c(A-),物料守恒:2c(Na+)=c(HA)+c(A-),消去c(Na+),则2c(OH-)=2c(H+)+[c(HA)-c(A-)],故D正确;
综上所述,本题选D。
(2)①已知a+b=12,该温度下水的离子积常数Kw=c(H+)×c(OH-)=10-a ×10-b =10-(a+b)=10-12 mol2·L-2;
综上所述,本题答案是:10-12。
②由于硫酸与NaOH溶液混合后,碱过量,所以混合后溶液中c(OH-)=(0.1×0.4-0.1×0.2)/0.2=0.1 mol·L-1,则c(H+)=KW/c(OH-)=10-12/0.1=10-11mol·L-1,故pH=11;
综上所述,本题答案是:11。
(3)常温下在20 mL 0.1 mol·L-1Na2CO3溶液中逐滴加入0.1 mol·L-1HCl溶液40 mL,先反应生成碳酸氢钠,再与盐酸反应生成二氧化碳、水,
①由反应及图象可以知道,在同一溶液中H2CO3、HCO3-、CO32-不能大量共存;
因此,本题正确答案是:不能。
②当pH=7时,溶液中溶质为碳酸氢钠、碳酸、氯化钠,溶液中存在电荷守恒,离子浓度等量关系为(电荷守恒):c(Na+)+c(H+)=c(Cl-)+c(HCO![]() )+c(OH-);
)+c(OH-);
综上所述,本题答案是:c(Na+)+c(H+)=c(Cl-)+c(HCO![]() )+c(OH-)。
)+c(OH-)。
③已知在25 ℃时,CO32-水解反应的平衡常数Kh=c(HCO3-)×c(OH-)/c(CO32-)=2×10-4,当溶液中c(HCO3-)∶c(CO32-)=2∶1时,c(OH-)=10-4mol/L,由Kw可以知道, c(H+)=10-10 mol/L,所以pH=10;
因此,本题正确答案是:10。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某化合物H的合成路线如下:
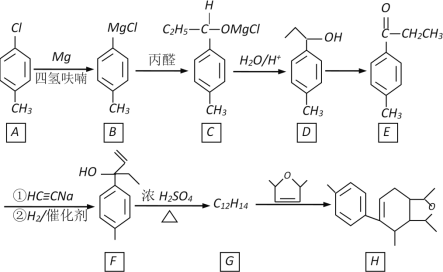
已知CH≡CH在NaNH2液氨条件下可生成CH≡CNa或NaC≡CNa
(1)A的化学名称是________________________,B→C的反应类型是________________
(2)D→E的反应试剂、条件是________,F中不含氧官能团名称是____________
(3)H的分子式是___________________
(4)F→G的化学方程式是________________
(5)W是E的同系物,比E少一个碳原子,则符合下列条件的W的同分异构体的结构简式是___________(写一种)
①有两种官能团
②遇FeCl3溶液显紫色
③核磁共振氢谱有五组峰,峰面积之比是3︰2︰2︰2︰1
(6)依据上述题目信息,写出用乙醛和乙炔为原料,制备化合物![]() 的合成路线(无机试剂任选)_________。
的合成路线(无机试剂任选)_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(NOC1)是一种黄色气体,沸点为-5.5。其液体状态呈红褐色。遇水易水解,伴随有氯伴随有氯化氢生成。某化学兴趣小组按下图装置用Cl2和NO制备NOC1。回答下列相关问题:

(1)仪器a的名称是_____,装置甲中反应的离子方程式是______.
(2)装置乙的作用是____,实验开始时,先打开活塞k,当观察到装置丙中出现____(填现象)时再缓缓通入Cl2.
(3)装置丙中生成NOC1的反应方程式是___,装置丁中冰盐水的作用是______.
(4)经分析该套装置设计上有一处明显缺陷,改进方法是_____(用文字描述)。
(5)工业制得的NOC1中常含有少量N2O4杂质,为测定产品纯度进行如下实验:称取1.441g样品溶于适量的NaOH溶液中,加入几滴K2CrO4溶液作指示剂,用0.8000mol/L硝酸酸化的AgNO3溶液滴定,若消耗AgNO3溶液的体积为25.00mL,则NOC1的质量分数为___%(保留2位小数);如果AgNO3溶液出现部分变质(变质的部分不参与反应),则测得的NOC1的质量分数会____(填“偏大”或“偏小”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学在日常生活和生产中有着重要的应用。下列说法不正确的是( )
A. 某雨水样品采集后放置一段时间,pH由4.68变为4.28,是因为溶液中的SO32-水解
B. 明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化
C. 将饱和FeCl3溶液滴入沸水中可制备Fe(OH)3胶体,利用的是盐类水解原理
D. 配制FeCl3溶液时加入少量的盐酸,抑制Fe3+水解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高分子合物J的合成路线如下:

已知:i、
ii、
(1)写出E的名称:_____________,由G生成H的反应类型为:______________。
(2)I中官能团名称:____________________。B→C的反应条件为:___________。
(3)由I可合成有机物K,K中含有3个六元环,写出I合成K的化学方程式:____________________________________________________。
(4)D→E反应的化学方程式:_____________________________。
(5)有机物L(C9H10O3)符合下列条件的同分异构体有______种。
①与FeCl3溶液发生显色反应
②与I具有相同的官能团
③苯环上有3个取代基
(6)结合上述流程中的信息,设计由![]() 制备
制备 的合成路线_____。合成路线流程图示例:
的合成路线_____。合成路线流程图示例:![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了测定某草酸(H2C2O4)溶液的浓度,进行如下实验:
取25.00mL某草酸溶液置于锥形瓶内,加入适量稀H2SO4后,用浓度为0.10molL-1的KMnO4溶液滴定到终点,所发生的反应为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O试回答:
(1)实验中,标准液KMnO4溶液应装在________式滴定管中,因为_____________;
(2)实验中眼睛注视_________________,直至滴定终点;判断到达终点的现象是___________________________________________ ;
(3)若实验所用KMnO4溶液体积为21.00mL,则草酸溶液的浓度为_______________;
(4)实验中,下列操作(其它操作均正确),会对所测草酸浓度有什么影响?(填偏大、偏小、无影响)
A.滴定前仰视刻度,滴定后俯视刻度________________________;
B.锥形瓶在盛放待测液前未干燥,有少量蒸馏水______________________________;
C.滴定过程中摇动锥形瓶,不慎将瓶内的溶液溅出一部分______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的是铁钉在水中被腐蚀的实验:

(1)甲图发生的是_________腐蚀,电极反应式是正极________,负极__________。
(2)乙图发生的是___________腐蚀,电极反应式是:正极________________,负极________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“探险队员”——盐酸,不小心走进了化学迷宫,不知怎样走出来,因为迷宫有许多“吃人的野兽”(即能与盐酸反应的物质或者是水溶液),盐酸必须避开它们,否则就无法通过.

(1)请你帮助它走出迷宫(请用图中物质前的序号连接起来表示所走的路线).______.
(2)在能“吃掉”盐酸的化学反应中,属于酸和碱中和反应的有________个,其中能“吃掉”盐酸的盐是___________________,写出该反应的化学方程式_____________________。
(3)在不能与盐酸反应的物质中,属于氧化物的是________________________________,(填写物质序号,下同),属于单质的是______________。
(4)如果将盐酸换成氧气,它能沿着盐酸走出的路线“走出”这个迷宫吗?为什么?______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着科学技术的发展,阿佛加德罗常数的测定手段越来越多,测定的精度也越来越高。现有一种简单可行的测定方法,具体步骤为:
①将NaCl固体研细、干燥后,准确称取mgNaCl固体并转移到定容仪器A中。
②用滴定管向A仪器中加苯,不断振荡,继续加苯到A仪器的刻度,计算出NaCl固体的体积为Vcm3。
(1)步骤①中仪器A最好使用___(填序号)。
A.量筒 B.烧杯 C.容量瓶 D.试管
(2)步骤②中是用酸式滴定管还是用碱式滴定管___,理由是___。
(3)能否用水代替苯___(填“是”或“否”),理由是___。
(4)已知NaCl晶体中,靠得最近的Na+、Cl﹣间的距离为acm(如图),则用上述方法测得的阿佛加德常数NA的表达式为___。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com